喜讯丨深圳细胞谷联合北大深研院发表双特异性CAR-T高水平文章
近期,深圳细胞谷研发部部长赵丽君博士以第一作者、北京大学深圳研究生院曹宇教授为通讯作者,在国际知名期刊《Protein & Cell》(SCI一区期刊,影响因子13.6)上发表论文“A novel loop-structure-based bispecific CAR that targets CD19 and CD22 with enhanced therapeutic efficacy against B-cell malignances”。而这项工作正是细胞治疗中基础研究到工业转化到临床应用的优秀案例。
嵌合抗原受体T(CAR-T)细胞疗法在治疗B细胞恶性肿瘤领域已取得显著成效,但部分患者仍面临复发问题。为解决抗原逃逸及抗原表达的异质性,研究者们设计了多种形式的识别双重或多种抗原的CAR构建体以降低复发率,然而近年来报道的几乎所有CD19/CD22双特异性CAR都存在CD22靶向不足的问题,这是由CD19抗体和CD22抗体的空间构型引起的。
大多数报道的CD19/CD22 CAR-T细胞在CD19刺激下保持强烈的反应,但在CD22介导的活性下表现出较低的效力。考虑到scFv聚集引起的潜在tonic信号,我们提出了一种新的CD19/CD22双特异性结构(CD19/CD22 LoopCAR-1),用CD22纳米抗体取代CD22 scFv。与已经上临床的LoopCAR-4或其他环状结构CD19/CD22 CAR相比,CD19/CD22 LoopCAR-1表现出更好的CD22重定向活性,这表明LoopCAR-1可能提供了几何上最优的免疫突触(IS),并展现出有效的双重特异性和突出的抗白血病活性。这种新颖的结构设计为使用带有纳米抗体和scFv进行环状结构设计提供了独特的思路,并可能将CAR-T细胞治疗的范围扩展到实体肿瘤,以及癌症以外的适应症。

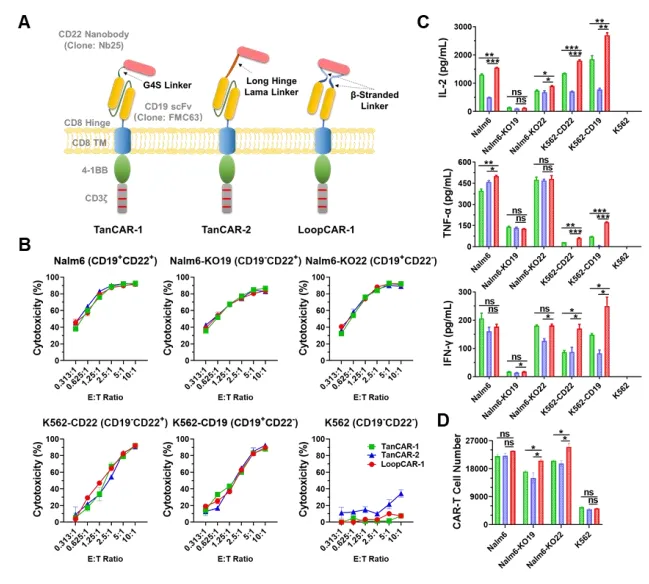
首先,研究人员分别采用了G4S Linker、Long Hinge Lama Linker和β-Stranded Loop Linker构建了三种不同形式的CD19/CD22 CAR,分别命名为TanCAR-1、TanCAR-2和LoopCAR-1。经验证,LoopCAR-1不仅显著增强CAR-T对B-ALL患者细胞的杀伤活性,也显著提高了细胞因子释放水平并促进细胞增殖。这些结果表明,环状结构可能是双特异性CD19/CD22 CAR的最佳设计。
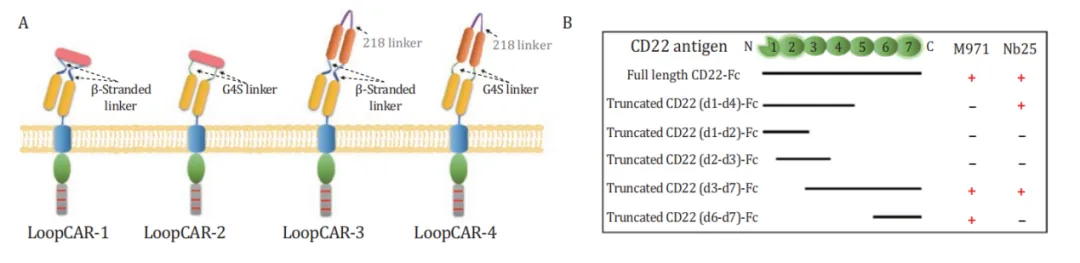
基于此环状结构,研究人员通过替换Linker和CD22纳米抗体,进一步设计了CD19/CD22环状CAR结构。
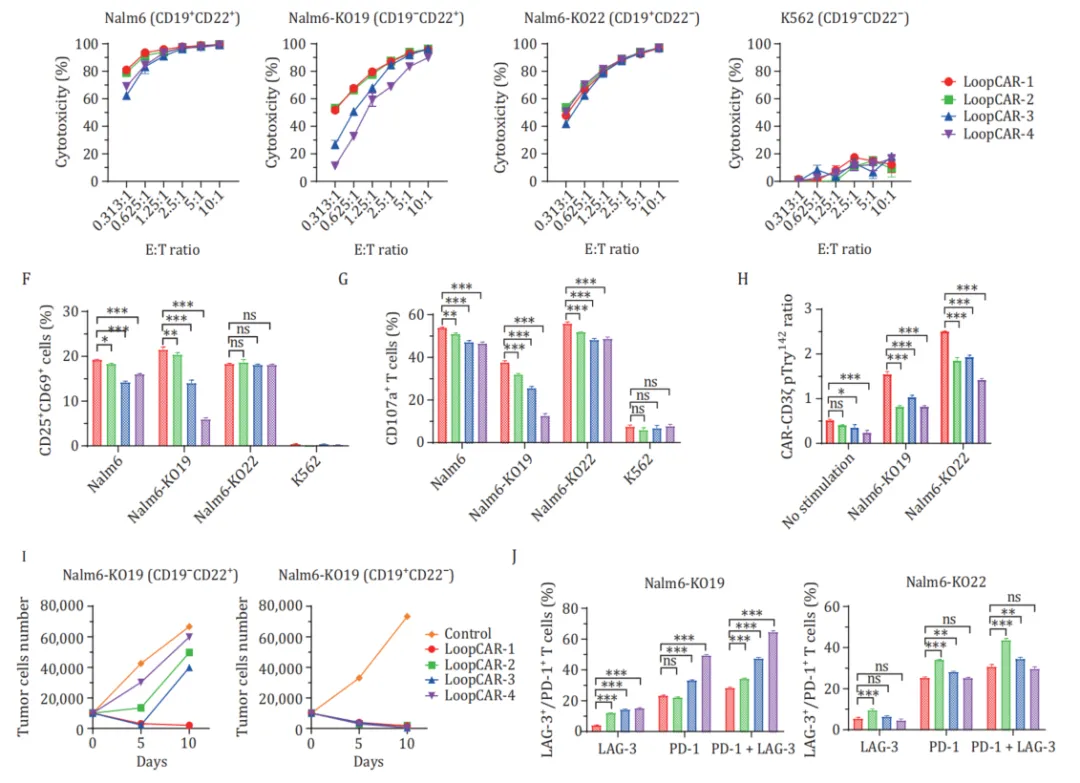
在四种结构中,LoopCAR-1和LoopCAR-2对Nalm6和Nalm6 KO19细胞的影响尤为显著。经过两轮靶细胞刺激后,所有结构的CAR-T都表现出相当的细胞毒性,而LoopCAR-1比其他双特异性CARs具有更持久的细胞杀伤活性。此外,我们观察到LoopCAR-1再刺激后效应T细胞群增加,但耗尽标志物的表达减少,这表明LoopCAR-1对CD19抗原丢失的靶细胞具有持续的抗肿瘤活性。以上结果显示了抗体和Linker的选择在CAR结构设计中的关键作用,LoopCAR-1是最佳的CD19/CD22双特异性CAR结构。
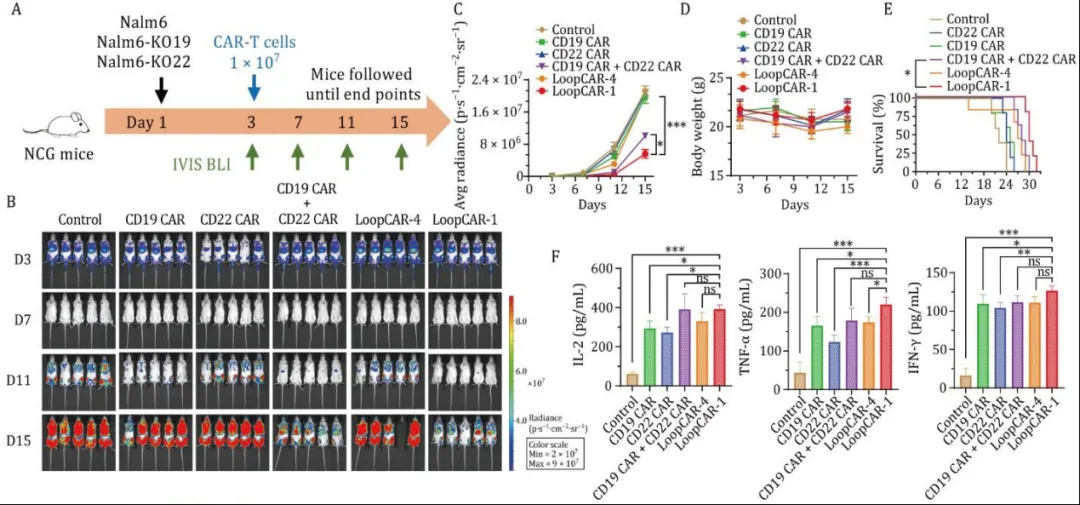
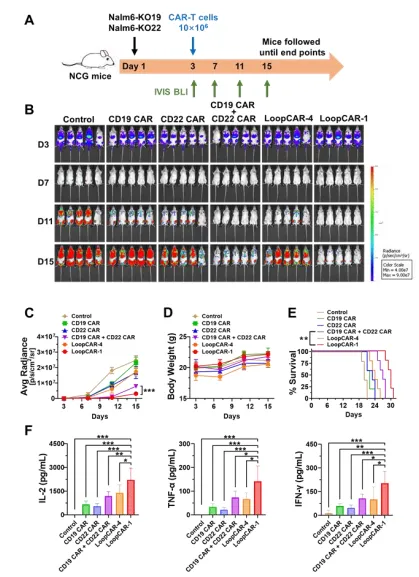
为了评估其体内的抗肿瘤效果,研究人员使用Nalm6细胞(CD19+CD22+)构建异种移植小鼠白血病模型测试各CAR-T细胞的疗效。结果显示,接受LoopCAR-1处理的小鼠体重未下降,且存活时间显著延长。此外,这些小鼠的血清细胞因子水平高于接受CD19 CAR、CD22 CAR或单靶点CAR-T联合治疗组。这些结果表明,LoopCAR-1在体内对CD19+CD22+肿瘤具有强效杀伤作用。
而后,研究人员进一步评估了LoopCAR-1在CD19或CD22敲除的免疫逃逸模型(1:1比例)和拟临床复发模型(1:1:1比例)中的表现,结果显示LoopCAR-1能显著抑制肿瘤生长,延缓疾病进展,延长生存期,提高血清细胞因子水平,且未引起体重下降。然而,与LoopCAR-1相比,LoopCAR-4和单靶点CAR-T细胞联合治疗组在减少肿瘤负荷方面表现不佳。这强调了LoopCAR-1结构的优越性。综上所述,针对白血病,LoopCAR-1结构的双靶点CAR-T发挥了最佳疗效,防止了免疫逃逸和与单特异性治疗相关的肿瘤复发。
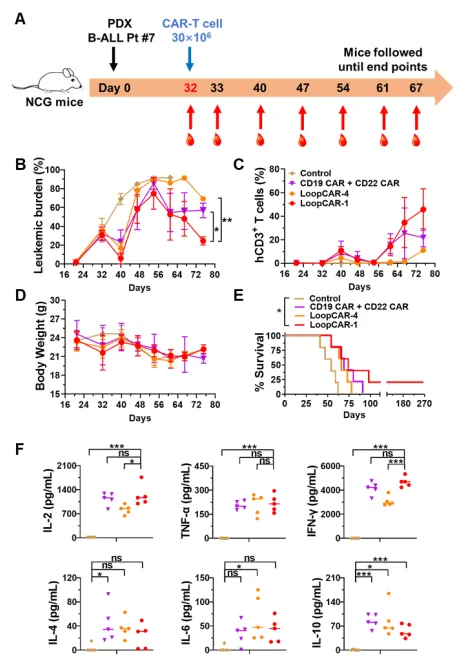
最后,研究人员评估了CAR-T细胞治疗对临床相关的B-ALL PDX模型的疗效。结果展示,尽管使用环状CAR或单靶点CAR联合治疗的小鼠均无法完全根除原代B-ALL细胞,但与其他CAR-T细胞疗法相比,LoopCAR-1治疗组在后期仍具有较强的抗白血病活性、更高的总存活率和更多的Th1细胞因子的产生。此外,复发后白血病细胞保持了CD19和CD22的表达,排除了CAR应激介导的抗原丢失。这些结果表明,LoopCAR-1对B-ALL PDX模型具有稳定的治疗效果,揭示其是一种很有前途的临床治疗候选药物。
综上所述,本研究开发了一种新型双特异性CD19/CD22 LoopCAR-T,相较于其他环状CD19/CD22 CAR,该结构在增强CD22重定向信号传导方面展现出显著优势。通过与已进入临床的CAR-T细胞或单靶点CAR-T细胞联合治疗组的对比,强调了双特异性CAR-T细胞结构设计和优化的重要性。对于表达CD19及或CD22的B-ALL或淋巴瘤患者,LoopCAR-1展现出了更持久的临床治疗价值。目前该新型双特异性CD19/CD22 LoopCAR-T已由深圳细胞谷制备并应用于临床,已在华中科技大学协和深圳医院(南山医院)进行4例B细胞恶性肿瘤患者的临床治疗,效果显著。感兴趣的广大读者们欢迎联系我司进行深入交流!









