肿瘤细胞免疫疗法--CAR-NK和CAR-M细胞疗法
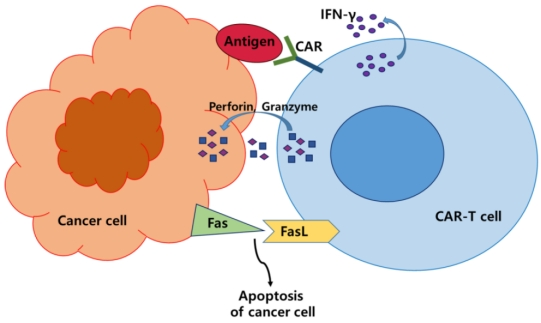
免疫系统中的T细胞可以靶向杀伤肿瘤细胞,而T细胞杀伤肿瘤细胞依赖于对肿瘤抗原的特异性识别。但T细胞受体(T cell receptor,TCR)识别肿瘤抗原的模式受到人类白细胞抗原(human Leukocyte antigen,HLA)分子的限制,且面对肿瘤细胞HLA分子表达的下调以及免疫抑制的肿瘤微环境,TCR很难激活T细胞发挥抗肿瘤作用。为了突破HLA分子的限制,一种工程化改造的分子——嵌合抗原受体(chimeric antigen receptor,CAR)诞生了。CAR的结构类似于TCR,由胞外特异性肿瘤抗原识别区、铰链区、跨膜结构域、共刺激域以及胞内信号传导域五部分组成。胞外特异性肿瘤抗原识别区可由抗体单链可变区(针对肿瘤抗原特异性抗体的重链和轻链)或纳米抗体组成,能够以非HLA分子限制的模式直接识别肿瘤相关抗原或者特异性抗原,并通过胞内信号域传导信号、活化效应T细胞实现特异性杀伤肿瘤的效果[1]。
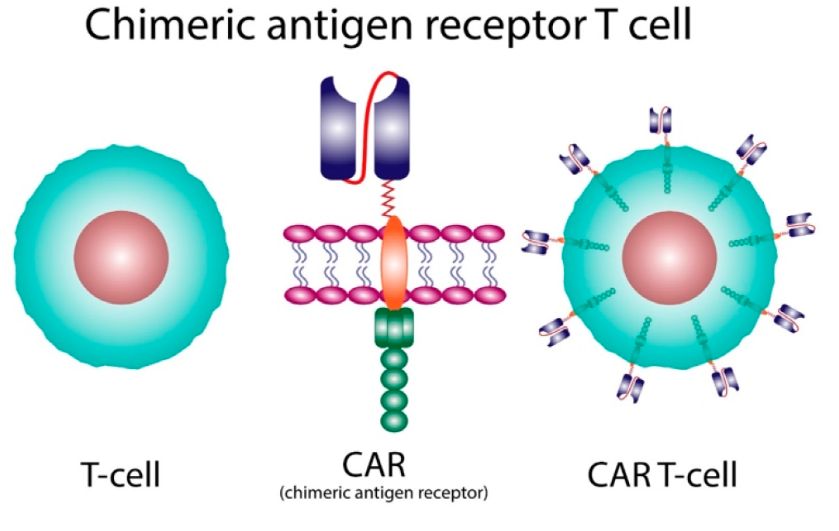
将这种针对肿瘤特异性抗原或者肿瘤相关抗原的CAR通过基因工程的方法表达于T细胞表面,并经体外扩增后过继输注给相应肿瘤患者的疗法称之为CAR-T细胞免疫疗法,而表达了CAR分子的T细胞被称为CAR-T细胞(图1)[2]。除T细胞外,CAR也能表达于其他免疫细胞表面,如自然杀伤细胞(Natural Killer cells,NK)、巨噬细胞(Macrophage)、γδT细胞、DC细胞等免疫细胞,这对应的就是CAR-NK细胞、CAR-M细胞、CAR-γδT细胞、CAR-DC细胞。
近些年,CAR-T疗法在恶性肿瘤的治疗上取得了显著成就,尤其是在血液瘤的治疗上表现出了极佳的治疗效果,被认为是最有希望治愈肿瘤的治疗方法之一。目前利用CAR-T技术治疗的血液系统肿瘤包括急性髓系白血病、急性淋巴细胞白血病、淋巴瘤、多发性骨髓瘤等,并且在治疗肝癌、前列腺癌等实体瘤中也具有一定的效果。截止2023年9月,全球共上市了9款CAR-T治疗药物,靶点为CD19和BCMA,主要用于治疗血液肿瘤。其中,据吉利德2023年前三季度财报统计,Yescarta(Anti-CD19 CAR-T)和Tecartus(Anti-CD19 CAR-T)两款细胞产品销售额达到14.02亿美金(合计约102亿人民币),其市场潜力可见一斑。
但其目前也存在一些挑战与不足。其一是临床治疗安全性问题,CAR-T疗法在临床容易出现细胞毒副作用,最常见的CAR-T细胞的毒副作用为细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)[3]。严重的CRS和ICANS 有致命风险,因此如何提高CAR-T疗法的安全性,降低细胞毒副作用,成为了细胞药物研发亟需解决的问题。其二是由于多方面的原因[4](详见前期推文),CAR-T疗法在实体肿瘤的治疗上效果不甚理想。第三则是由于目前CAR-T疗法为个体化定制治疗,产能受限,费用高昂,大多数国内患者无法支付。
基于自体CAR-T疗法在实体瘤中所面临的的种种问题,人们迫切期待一种可以通用的、现货型的、可以大规模制备的细胞治疗产品出现,而CAR-NK疗法,或将为实现这一目标带来希望。
三、CAR-NK疗法
自然杀伤细胞(NK细胞)来源于骨髓淋巴样干细胞,占成人外周血淋巴细胞的5%~15%,是重要的固有免疫细胞,因其非专一性的细胞毒作用而被命名。NK细胞在肿瘤免疫监视中发挥关键作用,其通过直接溶解和分泌细胞因子等作用杀伤肿瘤细胞,因此开发它的抗癌功能是近年来癌症研究的热点。
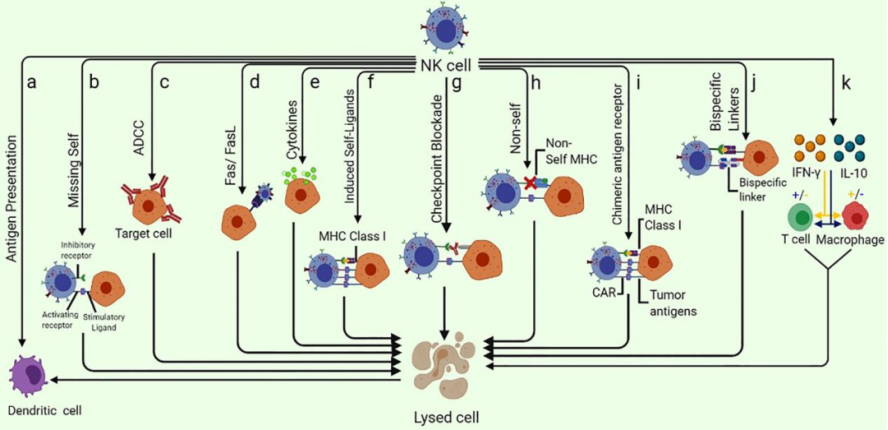
不同于T细胞通过TCR特异性识别MHC-抗原肽复合物产生活化信号进而激活的方式,NK细胞发挥杀伤靶细胞的作用无须抗原刺激、也无需抗原提呈,且不受自体MHC限制性。NK细胞表面表达复杂的受体谱,主要包括杀伤免疫球蛋白样受体(KIR)、C型凝集素样受体家族和NKp30、NKp44、NKp46等激活性自然细胞毒受体(NCR)。按其功能可分为抑制性和活化性受体,与相应配体作用分别传导抑制性和活化性信号,NK细胞的激活由2种信号间的平衡决定[5]。被激活的NK细胞通过多种机制“消灭”靶细胞细胞(如图3),例如:①释放穿孔素和颗粒酶,使靶细胞裂解或凋亡;②促进肿瘤细胞FasL表达,诱导肿瘤细胞凋亡;③释放 TNF-α、IFN-γ、GM-CSF 和趋化因子(例如 CCL1、CCL2、CCL3等),募集和激活其他效应免疫细胞等。
和CAR-T疗法相比,CAR-NK 疗法具有以下几个优势:
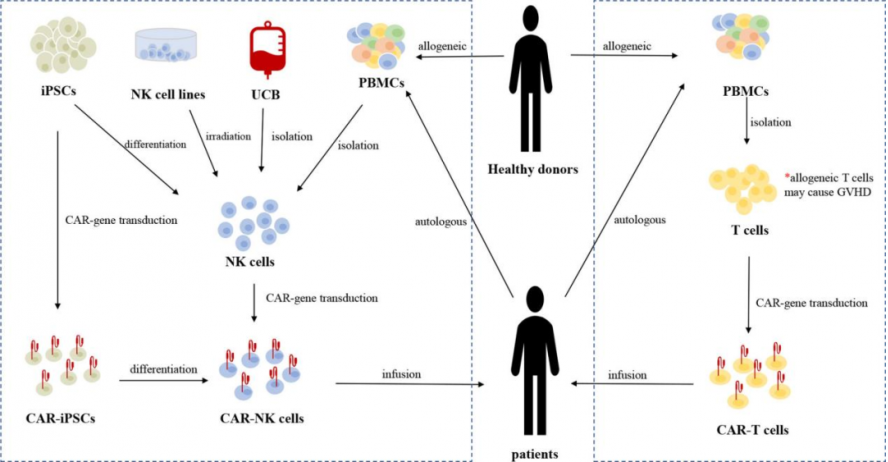
1)CAR-NK 细胞来源广泛(图4),可从包括 NK92 细胞系、PBMC 和 iPSC 在内的多种临床样本或商业化细胞系获取,且 CAR-NK 细胞可以作为“现货型”细胞治疗产品[6];
2)CAR-NK 细胞在循环中的寿命有限,因此对正常组织的靶向/脱瘤毒性风险相对较低;
3)使用CAR-NK细胞治疗后CRS风险低:不同于CAR-T细胞在体内持续扩增并产生如IL6、IL1β等促炎因子,NK细胞主要分泌IFN-γ和GM-CSF,且在体内数周内不会扩增,从而降低了CRS发生的风险;
4)CAR-NK细胞不需要进行严格的HLA基因匹配:异体来源NK细胞不表达个体特异性TCR,引起移植物抗宿主病(GVHD)的潜在风险远低于CAR-T细胞治疗;
5)NK细胞杀伤肿瘤细胞的途径多,经过CAR修饰的NK细胞既能够通过 CAR依赖性的方式清除抗原特异性肿瘤,又能通过NK细胞受体依赖性机制有效根除某些不表达CAR靶向抗原的异质性肿瘤。
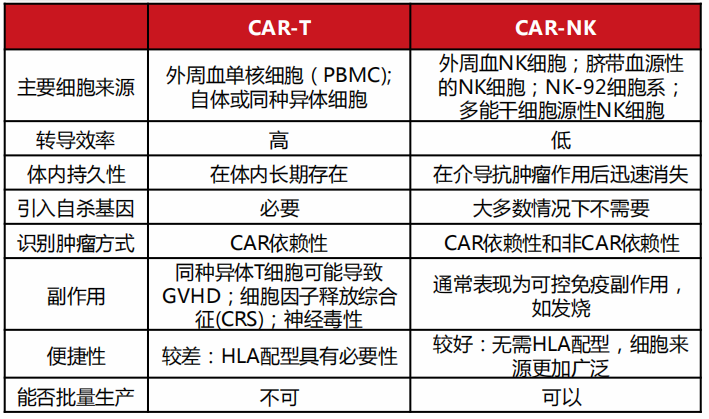
表1 CAR-T与CAR-NK的对比(表格来源:西南证券)
四、CAR-M疗法
巨噬细胞(M)具有高度异质性,可塑能力强,有吞噬作用、抗原呈递和浸润能力。巨噬细胞对抗癌症的尝试始于几十年前,然而早期临床试验的疗效评估表明巨噬细胞移植疗法效果甚微,巨噬细胞需要额外的信号来指导其对抗肿瘤。因此,以CAR-T/NK的发展潜力和制备过程作为参照模板,研究人员开始研究将单核/巨噬细胞作为细胞免疫治疗的载体细胞,结合目前蓬勃发展的嵌合抗原受体技术与日渐成熟的基因工程优化技术,从分子水平上改造单核/巨噬细胞,制备获嵌合抗原受体-巨噬细胞(CAR-M) ,利用其高效浸润性,增强其吞噬能力及抗原递呈能力,以应用于肿瘤领域。CAR-M有望成为细胞免疫治疗的新一代主角。

图5 巨噬细胞杀伤肿瘤示意图
与CAR-T不同,CAR-M主要有三大优势:
1) 首先巨噬细胞可以轻松侵入肿瘤微环境(TME)中吞噬肿瘤细胞,影响TME中肿瘤相关巨噬细胞(TAM)的比例,改变TAM的表型(由M2转变为M1);
2) 其次,巨噬细胞还可上调抗原呈递机制相关分子的表达,如组织相容性复合物 II 类 (MHC-II)、CD80和CD86,可作为抗原呈递细胞,通过交叉呈递吞噬抗原来激活适应性免疫应答;
3) 最后CAR-M的循环有时限,非肿瘤靶向毒性较小。
CAR-M的首次报道是在2020年,目前绝大多数研究仍处于科研阶段,产业化还在初期阶段。虽然从理论而言,CAR-M疗法对实体瘤具有明显优势,但还处于“婴儿期”,要想真正加入临床应用,仍需克服许多困难,如:
1)来源与扩增问题。与CAR-T/NK不同,T细胞和NK细胞可从患者体中提取而来然后可在实验室中大量扩增,但巨噬细胞在体外几乎不扩增,大量获取是一大难题。而永生化或肿瘤细胞系并不能良好的代表原代细胞的性质,对于CAR-M的研究提供的作用有限。
2)巨噬细胞天然对常用的病毒载体具有抗性。巨噬细胞是人体抗击癌细胞和病毒的第一道防线,因此可能会对常用的标准病毒载体产生抗性,导致病毒载体无法高效感染巨噬细胞制备CAR-M,这是限制CAR-M疗法开发的重大挑战之一。且转导后的CAR-M需要进行阳性分选才能更好的进行下游抗肿瘤功能验证。
目前深圳细胞谷对于CAR-NK和CAR-M的制备方面均有重大突破,随时欢迎各位CGT领域前辈一起交流学习和莅临指导工作。
参考文献
[1] 赵嫄,胡婉丽,张连生.嵌合抗原受体疗法在血液肿瘤免疫治疗中的研究进展与应用前景[J/CD].中华临床医师杂志:电子版,2014,8(6):1158-1161.
[2]Chen YJ, Abila B, Mostafa Kamel Y. CAR-T: What Is Next? Cancers (Basel). 2023 Jan 21;15(3):663.
[3]李贺,任嘉慧,石颖慧等.CAR-T细胞疗法传统领域的前沿进展[J].中国医药导刊,2022,24(10):966-973.
[4]党可纯,王金伟.CAR-T细胞治疗实体瘤的挑战与应对策略[J].药学与临床研究,2022,30(06):529-535.
[5]刘洪秀,韩艳秋.CAR-NK细胞治疗血液肿瘤的研究进展[J].临床血液学杂志,2023,36(1):76-80.
[6]Lu H, Zhao X, Li Z, Hu Y, Wang H. From CAR-T Cells to CAR-NK Cells: A Developing Immunotherapy Method for Hematological Malignancies. Front Oncol. 2021 Aug 6;11:720501.