增强抗肿瘤活性和持久性的新策略之降低CAR-T细胞甲基化水平
DNA甲基化是指DNA序列上特定的碱基在DNA甲基转移酶(DNA methyltransferase,DNMTs)的催化作用下,在胞嘧啶的C-5位、腺嘌呤的N-6位及鸟嘌呤的G-7位等位点发生甲基化修饰。一般情况下,DNA甲基化在 CpG 二核苷酸中胞嘧啶残基的 5′-C上添加甲基[1]。
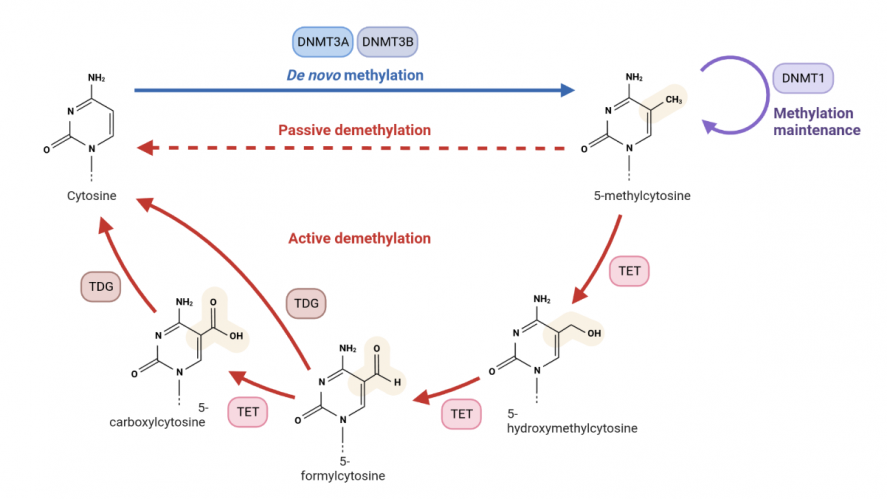
图1 DNA甲基化与去甲基化示意图(图片来源biorender)
真核生物中的DNA甲基化是一种重要的表观遗传修饰,可调节基因表达,在胚胎发育中至关重要。它涉及到遗传物质稳定、基因表达调控、X染色体失活、转座子沉默、组蛋白修饰等多个方面。发生DNA甲基化后,若在细胞分裂过程中不被纠正,就会诱发遗传病或癌症,且生物体甲基化的方式是稳定的,可遗传的。因此,DNA甲基化失调与人类疾病密切相关,例如自身免疫性疾病、代谢紊乱、神经系统疾病和癌症等[2]。
DNA的甲基化改变包括高甲基化和低甲基化两种状态,其中DNA高甲基化是肿瘤早期诊断与预后判定的潜在生物学标志。当其发生高甲基化时,常导致细胞周期调控紊乱,DNA修复基因等转录沉默,从而导致许多细胞通路失活,影响正常细胞的生长调控分化,进而导致肿瘤的发生。例如,p16INK4a基因启动子高甲基化存在于多种实体肿瘤中,如肝癌、肺癌、胰腺癌、乳腺癌、宫颈癌或膀胱癌,以及黑色素瘤和胶质瘤。p16INK4a的过表达参与了细胞衰老、衰老和细胞周期进程。该蛋白通过抑制周期蛋白依赖性激酶4和6来阻断细胞周期进程,而周期蛋白依赖性激酶4和6介导视网膜母细胞瘤蛋白(pRB)在G1期的磷酸化,从而阻断细胞周期进程。DNA高甲基化导致p16INK4沉默增加,导致pRB磷酸化水平增加,从而导致无限细胞增殖[3]。而低甲基化效应则会导致DNA损伤增加、染色质解凝和染色体不稳定。此外,DNA低甲基化可以激活被高甲基化启动子沉默的基因。例如,来自 MAGEA 基因仅在精原细胞中表达,而不在其他体细胞组织中表达。然而,当它们的启动子发生去甲基化时,它们可在各种癌症中表达。通常MAGEA基因的异常表达与乳腺、肺和结直肠肿瘤的侵袭性和恶性增加有关[4]。
DNA甲基化水平变化可推动肿瘤的发生发展,因此DNA去甲基化也成为了肿瘤治疗的重要方向。目前最常用的治疗策略就是开发小分子药物去调控DNA甲基化关键酶DNMT的活性。即针对DNMT的底物胞嘧啶设计胞嘧啶类似物,这些胞嘧啶类似物可以与DNMT发生共价结合,使DNMT无法从染色质上脱离,从而抑制其活性。目前胞嘧啶类似物已经有两种药物上市,分别是阿扎胞苷和地西他滨。阿扎胞苷是胞苷的嘧啶核苷类似物,在细胞摄取和酶促生物转化为三磷酸核苷酸后,将阿扎胞苷掺入DNA和RNA中,可通过抑制DNA/RNA甲基转移酶,抑制DNA合成和细胞增殖,减缓疾病进程。阿扎胞苷主要用作抗肿瘤药,临床上用于治疗乳腺癌、肠癌、黑色素瘤等。适用于在强化诱导化疗后首次完全缓解(CR)或首次完全缓解但血液计数未完全恢复(CRi),并且无法继续完成强化治疗的成人急性髓细胞性白血病患者。地西他滨是一种天然2′-脱氧胞苷酸的腺苷类似物,通过抑制DNA甲基转移酶,减少DNA的甲基化,从而抑制肿瘤细胞增殖以及防止耐药的发生。地西他滨是目前已知最强的DNA甲基化特异性抑制剂,属于S期细胞周期特异性药物本品。适用于 IPSS 评分系统为中危-1、中危-2 和高危的初治、复治骨髓增生异常综合征(MDS)患者,包括原发性和继发性的 MDS,按照 FAB 分型所有的亚型:难治性贫血,难治性贫血伴环形铁粒幼细胞增多,难治性贫血伴原始细胞增多,难治性贫血伴原始细胞增多-转化型,慢性粒-单核细胞白血病。
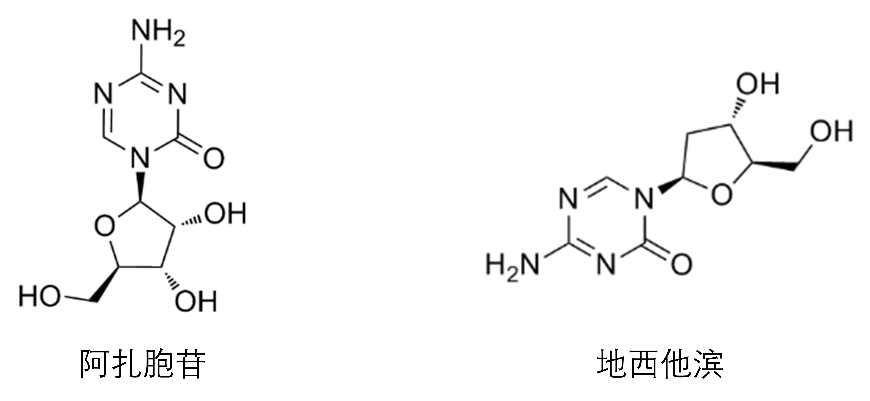
图2 阿扎胞苷和地西他滨结构式
CAR-T疗法是针对癌症的免疫疗法中最重要的新进展之一,并在血液肿瘤中取得了许多突破,但CAR-T疗法通常会受到T细胞耗竭的限制。临床上,对治疗中或复发后的活检样本进行分析将有助于确定CAR-T细胞衰竭导致患者疾病控制丧失的程度。有学者向B-ALL病人体内输注CD19靶向、基于4-1BB的CAR-T细胞,在4周后获取到了衰竭相关的DNA甲基化特征。另一项研究表明,CAR-T输注后几个月,慢性淋巴细胞白血病患者的血液中持续存在TIM3+PD-1+ CAR-T细胞,这些细胞在临床结果较差的患者中富集[5]。如果CAR-T细胞确实因衰竭而受损,那么中断这种功能低下的细胞状态就会提高疾病的治疗效果。美国约翰霍普金斯大学西德尼基梅尔综合癌症中心Christopher J. Gamper 和 Kenneth R. Cooke团队研究发现DNA甲基转移酶3a(DNMT3a)是稳定活性T细胞反应的表观遗传机制重要组成部分[6]。研究发现敲除CAR-T细胞的DNMT3a基因,能够防止T细胞衰竭,并增强抗肿瘤活性[7]。同时地西他滨处理的CAR-T细胞,在体外和体内研究中的抗肿瘤活性、细胞因子产生和增殖均得到增强。此外,经过处理后CAR-T细胞可以在低剂量下清除体积庞大的肿瘤,并在肿瘤再攻击时建立有效的记忆反应[8]。这些结果表明,DNMT3a可作为提高CAR-T疗法效果的通用靶标,与其联用为开发更有效的CAR-T细胞疗法提供了新的思路。
参考文献:
[1]Schübeler Dirk. ESCI award lecture: regulation, function and biomarker potential of DNA methylation. European journal of clinical investigation. 2015 Mar;45(3):288-93.
[2]Martisova Andrea, et al. DNA Methylation in Solid Tumors: Functions and Methods of Detection. International journal of molecular sciences. 2021 Apr 19;22(8):4247.
[3]Junan Li , et al. Regulatory mechanisms of tumor suppressor P16(INK4A) and their relevance to cancer. Biochemistry. 2011 Jun 28;50(25):5566-82.
[4]Poojary Manish, et al. Prognostic Value of Melanoma-Associated Antigen-A (MAGE-A) Gene Expression in Various Human Cancers: A Systematic Review and Meta-analysis of 7428 Patients and 44 Studies. Molecular diagnosis & therapy. 2020 Oct;24(5):537-555.
[5]Chow Andrew, et al. Clinical implications of T cell exhaustion for cancer immunotherapy. Nat Rev Clin Oncol. 2022 Dec;19(12):775-790.
[6]Ktena YP, et al. Donor T cell DNMT3a regulates alloreactivity in mouse models of hematopoietic stem cell transplantation. J Clin Invest. 2022 Jul 1;132(13):e158047.
[7]Prinzing Brooke, et al. “Deleting DNMT3A in CAR T cells prevents exhaustion and enhances antitumor activity. Sci Transl Med. 2021 Nov 17;13(620):eabh0272.
[8]Wang Yao, et al. Low-dose decitabine priming endows CAR T cells with
enhanced and persistent antitumour potential via epigenetic reprogramming. Nat Commun. 2021 Jan 18;12(1):409.
免责声明:深圳细胞谷致力于研究细胞与基因疗法,为推动新兴技术,让更多人了解生物医药新发展。本文内容仅作信息交流使用,本平台对文中内容、陈述、观点判断保持中立,不代表深圳细胞谷立场和观点。本文相关信息不得用作诊断或治疗,不能代替专业医学意见,本公司网站将不承担任何责任。以上声明内容的最终解释权归本公司网站所有,本声明将适用本公司网站所有时间分享的文章,谢谢合作! 版权说明:文章版权归深圳细胞谷所有,欢迎个人转发发至朋友圈,媒体或机构在未经授权下,以任何形式转载载到其他平台,将视为侵权。如需转载,请联系邮箱:contact@sz-cell.com









