点击蓝字 关注我们
上皮性卵巢癌(epithelial ovarian cancer,EOC)是一种常见的妇科恶性肿瘤,在早期往往没有明显症状。大多数患者在被诊断时已经处于疾病的晚期,但这时肿瘤可能已经转移,在腹水中漂浮生长和盆腔内种植转移是其主要的转移方式。尽管EOC初期的治疗效果趋于良好,但多数患者最终会对化疗产生耐药性,导致疾病复发甚至死亡。间皮素(mesothelin,MSLN)是一种糖基磷脂酰肌醇锚定的细胞表面糖蛋白,它在多种癌症中过表达,其中在卵巢癌的表达最高。它的高表达与晚期肿瘤分期和高转移率相关,这使其成为诊断、预后评估和治疗策略开发的重要靶点。针对间皮素的治疗方法正在积极研究中,并且已经显示出治疗EOC的潜力。
随着免疫疗法的兴起,特别是嵌合抗原受体(CAR)T细胞疗法在血液恶性肿瘤中展现的显著成效,科学家们开始探索其在实体瘤,尤其是EOC治疗中的潜力。在EOC治疗的创新研究中,丹娜法伯癌症研究所的研究人员发现,他们改造后的记忆样NK细胞(cytokine-induced memory-like NK cell,CIML NK)不仅在体外实验中展现出卓越的抗肿瘤活性,而且在体内模型中也显著抑制了肿瘤生长和转移。这项研究成果发表在《Science Advances》杂志上,论文标题为“CAR memory–like NK cells targeting the membrane proximal domain of mesothelin demonstrate promising activity in ovarian cancer”。目前,深圳细胞谷CAR-NK制备工艺已实现重大突破,临床疗效显著。

该研究首先从健康供体的外周血中分离出NK细胞,并通过特定细胞因子(IL-12、IL-18和IL-15)的短暂激活,诱导其转化为具有记忆样特性的CIML NK细胞。CIML NK细胞与EOC 细胞系(OVCAR8、SKOV3、OVCAR3、CaOV3 、 CaOV4)共培养6小时后,在体外实验中显示出了增强的细胞毒性、脱颗粒化(CD107a)和干扰素γ(IFN-γ)产生,预示着其在抗肿瘤活性方面的潜力。
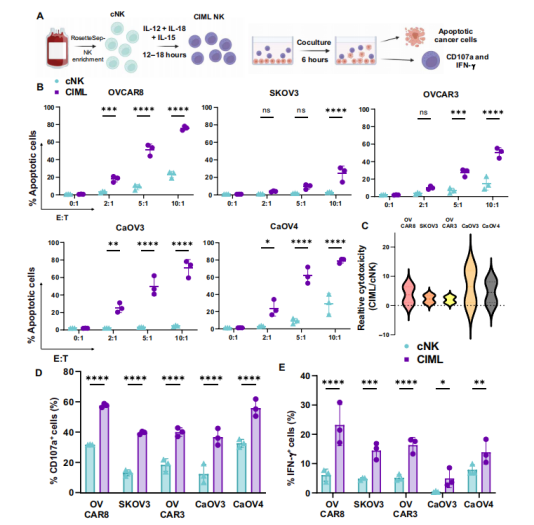
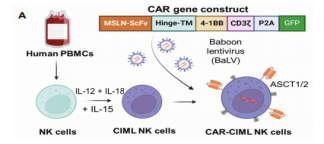
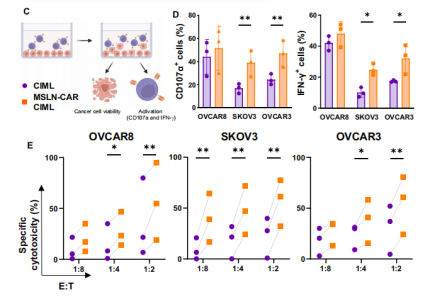
随后,研究团队设计了一种新型的CAR,专门靶向EOC中高表达的MSLN蛋白的膜近域。通过狒狒慢病毒(Baboon lentivirus,BaLV)介导,成功将MSLN-CAR基因转导入CIML NK细胞,制备出MSLN-CAR CIML NK细胞。这些细胞在体外实验中对EOC细胞系显示出显著的细胞毒性和激活状态。在体外实验中,MSLN-CAR CIML NK细胞对EOC细胞系(包括OVCAR8、SKOV3和OVCAR3)表现出了显著的细胞毒性。与未转导的CIML NK细胞相比,MSLN-CAR CIML NK细胞在与EOC细胞系共培养后,显示更高表达的CD107a和IFN-γ,表明其具有更强的抗肿瘤活性。
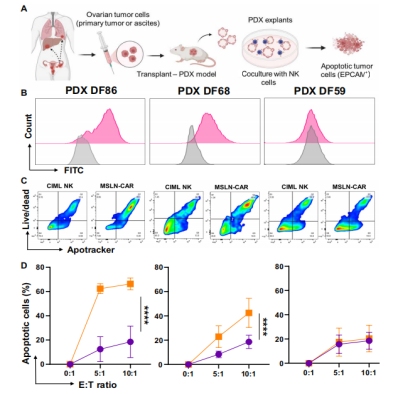
为了进一步验证MSLN-CAR CIML NK细胞在体内的疗效,研究人员在EOC的异种移植(PDX)模型中进行测试。结果显示,MSLN-CAR CIML NK细胞在体内不仅能够显著抑制肿瘤生长,还能有效防止肿瘤的转移扩散。此外,即使在模拟患者腹水的免疫抑制环境下,这些MSLN-CAR CIML NK细胞也能保持抗肿瘤活性。
综上所述,该研究成功展示MSLN-CAR CIML NK细胞在EOC治疗中的显著效果。无论是在体外还是体内实验中,都显示出对肿瘤生长和转移很大程度上的抑制作用。这一疗法的潜力不仅在于其直接的抗肿瘤效果,更在于其可能克服肿瘤微环境中的免疫抑制,为EOC的免疫治疗提供了新的策略和希望,也为未来的临床试验和可能的治疗方案奠定了基础。目前,深圳细胞谷已布局血液瘤和实体瘤等领域多种靶点,超过五十余个肿瘤相关性靶点储备,丰富的CAR-T和CAR-NK临床经验,助力更好的临床转化应用。
免责声明:深圳细胞谷致力于研究细胞与基因疗法,为推动新兴技术,让更多人了解生物医药新发展。本文内容仅作信息交流使用,本平台对文中内容、陈述、观点判断保持中立,不代表深圳细胞谷立场和观点。本文相关信息不得用作诊断或治疗,不能代替专业医学意见,本公众平台将不承担任何责任。以上声明内容的最终解释权归本公众平台所有,本声明将适用本平台所有时间分享的文章,谢谢合作!
版权说明:文章版权归深圳细胞谷所有,欢迎个人转发至朋友圈,媒体或机构在未经授权下,以任何形式转载到其他平台,将视为侵权。转载授权请在「深圳细胞谷」微信公众号回复“转载”,获取转载须知。

往期推荐 //
关于深圳细胞谷
深圳细胞谷生物医药有限公司(下称:深圳细胞谷)是国内唯一一家可提供工业级逆转录病毒载体的细胞与基因治疗一站式解决方案服务商,由来自美国哈佛大学和加州大学圣迭戈分校等海归科学家联合创办,拥有国内首批掌握工业级逆转录病毒载体技术(PackRV-SS系统)的研发生产团队。深圳细胞谷已建成规范化,标准化,工业化生产GMP级逆转录病毒载体及CAR-T等细胞产品管线,已在深圳、北京和中山三地建立产业联动,建成共计超万平符合国际GMP标准的生产车间及研发实验室。深圳细胞谷从病毒载体管线,到细胞产品管线,再到IIT/IND/NDA辅助申报,再到行业内人才培养已建立成熟的全流程、一站式委托服务,建有逆转录病毒、慢病毒等多种病毒载体生产管线及CAR-T、CAR-NK、TCR-T等细胞生产管线。同时与审评检验机构、科研院所、医院和行业龙头企业深度合作,提供IIT、IND辅助申报服务。
深圳细胞谷是深圳市生物医药产业重大公共服务平台、深圳市重大项目、深圳市高新区发展专项计划创新平台成果产业化基地、“聚龙领军人才”D类高成长性企业、细胞产业关键共性技术国家工程研究中心病毒载体共性技术研究平台、中国食品药品企业质量安全促进会副会长单位、深圳市医学研究专项资金依托单位、深圳市生物医药产教联盟副理事长单位、全国生物技术行业产教融合共同体常务理事单位、深圳市坪山区十大创新平台、科技型中小企业、创新型中小企业、深圳市坪山区大学生实习基地,是深圳市最新公布的“20+8”战略性新兴产业项目,荣获第十二届中国创新创业大赛优秀企业奖。深圳细胞谷晋级第十二届中国创新创业大赛全国赛,成为本届深圳市唯一晋级国赛的细胞与基因治疗企业。
左右滑动可浏览更多图片
END

微信公众号

市场部:赖女士
了解更多内容请登录
www.sz-cell.com
全国统一服务热线
400-800-1266
 扫一扫,关注我们最新消息
扫一扫,关注我们最新消息 工作时间:周一至周五 9:00-18:00
联系人:赖女士
手机:13670105633
邮件:laijiaqi@sz-cell.com
地址:深圳市坪山区坑梓街道金沙社区荣田路1号海普瑞生物医药生态园
