免疫调控新靶点:GPR25-CXCL17趋化亲和轴
淋巴细胞在体内的迁移对于免疫监视、炎症反应和免疫耐受的建立至关重要。这些细胞通过特定的趋化因子受体被引导至特定的组织和器官,并在那里执行免疫防御、调节和监视功能。目前已有研究揭示了小肠、结肠和皮肤的淋巴细胞趋化机制,但对于呼吸道和非肠道粘膜组织的选择性趋化因子知之甚少。这些部位的免疫环境独特,需要特别的免疫细胞类型和功能来保护和维持健康。因此,识别和理解这些部位的趋化因子作用机制对于揭示免疫细胞如何被定向到这些组织具有重要意义。
美国斯坦福大学医学院Borja Ocón,Menglan Xiang和Yuhan Bi共同合作取得了重要进展。他们研究发现了肺、非肠粘膜和中枢神经系统的淋巴细胞GPR25-CXCL17趋化亲和轴,该轴参与调控非肠道粘膜和中枢神经系统的免疫和耐受性,相关研究成果已于2024年9月18日在线发表于《Nature》。接下来将大致介绍一下这篇研究。

在该研究中,首先研究人员通过多组学数据分析和单细胞转录组分析将GPR25确定为关键的淋巴细胞趋化性受体,并进一步将CXCL17鉴定为GPR25的潜在配体。在此基础上,通过流式细胞术,免疫组化,RNAscope,体外趋化实验和动物实验等方法揭示了GPR25-CXCL17轴在淋巴细胞归巢、组织驻留记忆和免疫调节等功能中的关键作用,在增进对淋巴细胞迁移机制理解的同时为开发新的免疫治疗策略提供了潜在的靶点。
单细胞转录组数据分析结果表明,GPR25在呼吸道(包括鼻腔、气管和支气管)中的淋巴细胞表达水平显著高于肠道淋巴细胞。这一发现表明GPR25可能在呼吸道和非肠道粘膜的免疫监视中发挥重要作用。其中,GPR25在CD8 T细胞中的表达较为突出,这可能与这些细胞在粘膜免疫中的功能有关。值得关注的是,人类脑脊液(CSF)中的T细胞也存在GPR25的表达,这暗示GPR25可能在CNS的免疫调节中也具有重要意义。
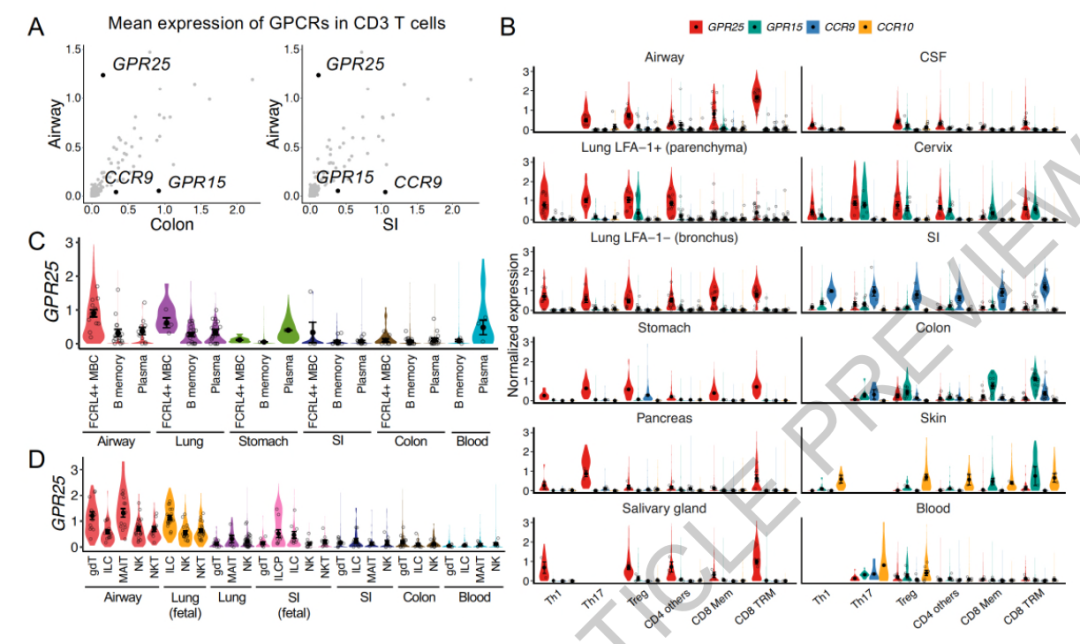
图1. GPR25在不同组织中的淋巴细胞中的表达水平
针对胸腺淋巴细胞的单细胞转录组分析结果表明,GPR25的表达水平在特定天然T细胞亚群的成熟过程中存在上调,这表明GPR25可能有助于先天T细胞迁移到目标组织。而在扁桃体中,GPR25的表达水平在激活的B细胞和T细胞中出现了上调,这同样表明其可能与淋巴细胞的迁移作用相关。值得关注的是,在胸腺和外周淋巴组织中,GPR25的表达水平均在调节性T细胞(Tregs)的发育过程中出现上调,这表明其可能在维持免疫耐受和预防自身免疫反应中发挥作用。
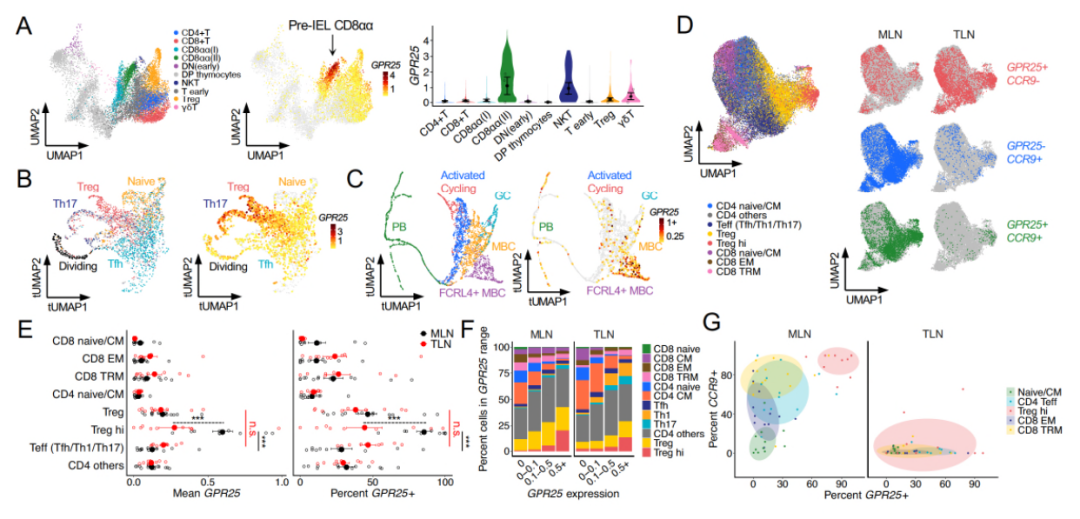
图2. GPR25在不同发育和激活状态的淋巴细胞中的表达水平
在确定GPR25为关键性的淋巴细胞趋化性受体后,研究者尝试通过生物信息学手段对与其存在相互作用的配体进行鉴定。以GPR25的结构特性为基础,通过计算机模拟和结构域预测确定筛选标准,在获得多个候选配体后进一步评估其与GPR25在49种非淋巴组织中的表达相关性。结果表明,CXCL17的表达模式与GPR25阳性细胞的组织浸润相关,提示CXCL17可能是GPR25的潜在配体。体外实验表明,表达GPR25的细胞系可以与Human IgFc-4CysCXCL17结合,而这一作用可以被未标记的4CysCXCL17阻断,这初步印证了生信分析的结果,证明了GPR25与CXCL17在体外存在相互作用。
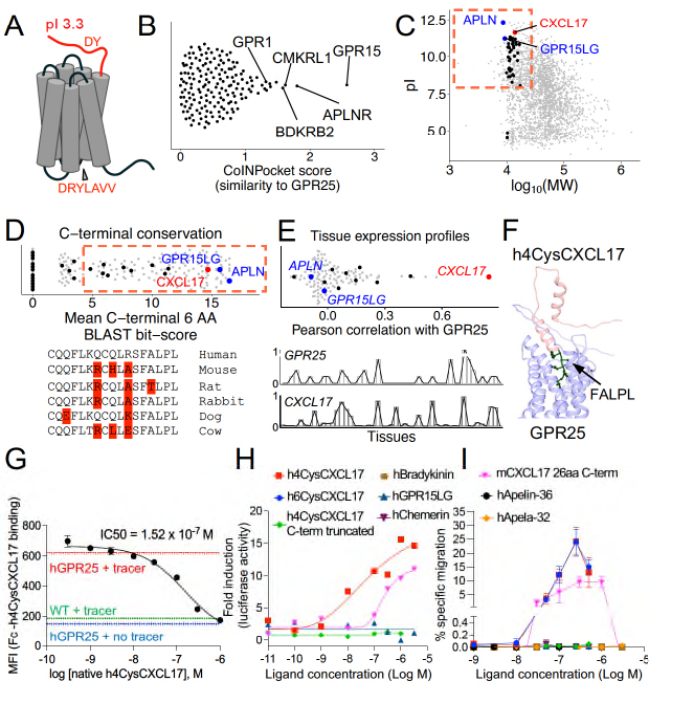
图3. 生物信息学及体外实验验证GPR25与CXCL17的相互作用
接下来,研究人员尝试验证CXCL17对表达有GPR25的淋巴细胞是否具有趋化作用。结果表明,在稳定表达GPR25的L1.2细胞系中,CXCL17可以以剂量依赖性的方式激活RhoA信号通路。且GPR25阳性细胞对CXCL17有高效迁移反应,而GPR25阴性细胞无此反应。此外,人类PBMC和扁桃体中的T细胞也能响应CXCL17进行迁移,其中GPR25阳性细胞迁移能力更强。以上结果表明,表达有GPR25的淋巴细胞在体外对CXCL17具有趋化作用,进一步证明了CXCL17与GPR25间存在轴向趋化作用。
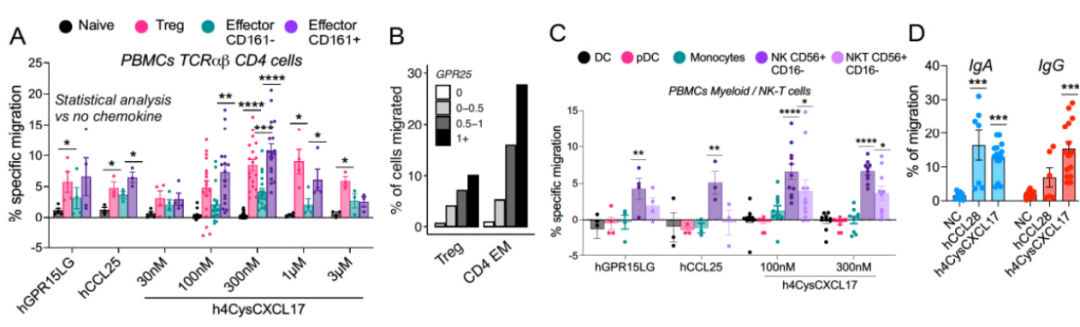
图4. 血液淋巴细胞对CXCL17的趋化作用验证
CXCL17已被证实粘膜组织中存在表达,但其在不同器官中的全面表达模式尚不完全清楚。为了填补这一空白,研究人员利用人类蛋白质图谱数据库的数据,分析了CXCL17在多种上皮细胞中的表达情况,结果显示CXCL17在呼吸道、食道、胃、胆管等多种粘膜组织中的上皮细胞存在广泛表达,尤其在气道上皮细胞中的表达量最高。此外,CXCL17也在中枢神经系统的神经元中表达,但在胶质细胞中表达较低。这一结果得到了RNAscope和免疫组化实验的证实。总体而言,这一结果与对CXCL17的功能预测结果相符合,并提示GPR25- CXCL17轴可能在CNS的免疫调节中发挥作用。
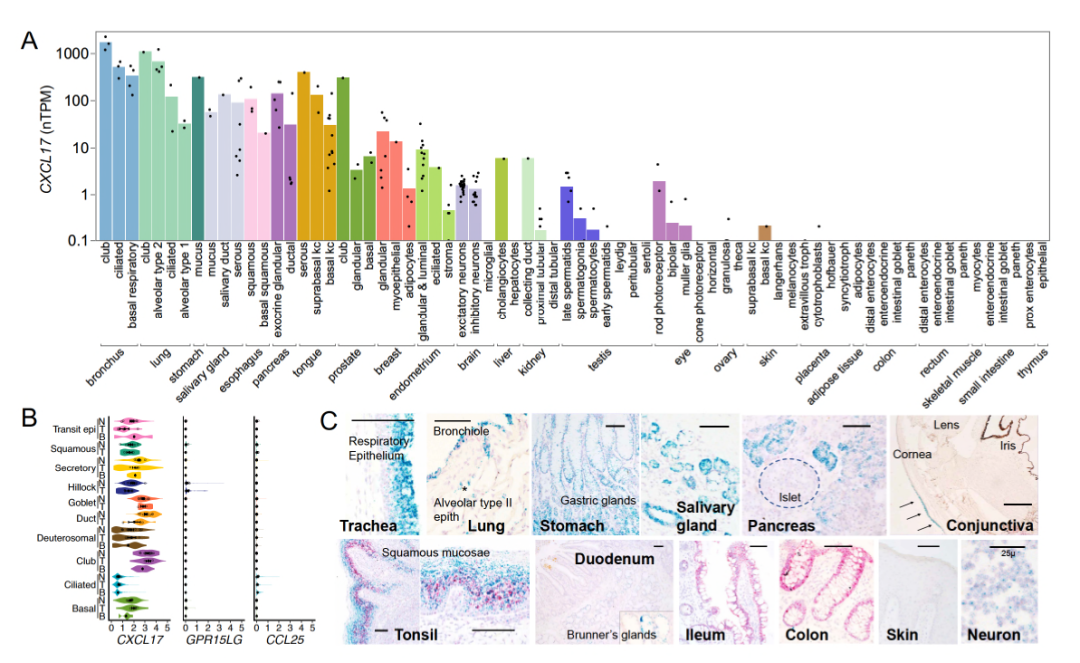
图5.不同器官中CXCL17表达水平分析
最后,研究者尝试通过体内实验验证GPR25-CXCL17轴介导的淋巴细胞归巢作用,结果表明,等量混合注射后,与对照组相比,转导有GPR25的T细胞更倾向于定位到生殖道、胃和气管等部位。在野生型小鼠中,GPR25显著增强了淋巴细胞对特定粘膜组织的归巢能力,而在CXCL17基因敲除小鼠中,这种效应消失,这充分证实了CXCL17是GPR25的主要功能性配体。
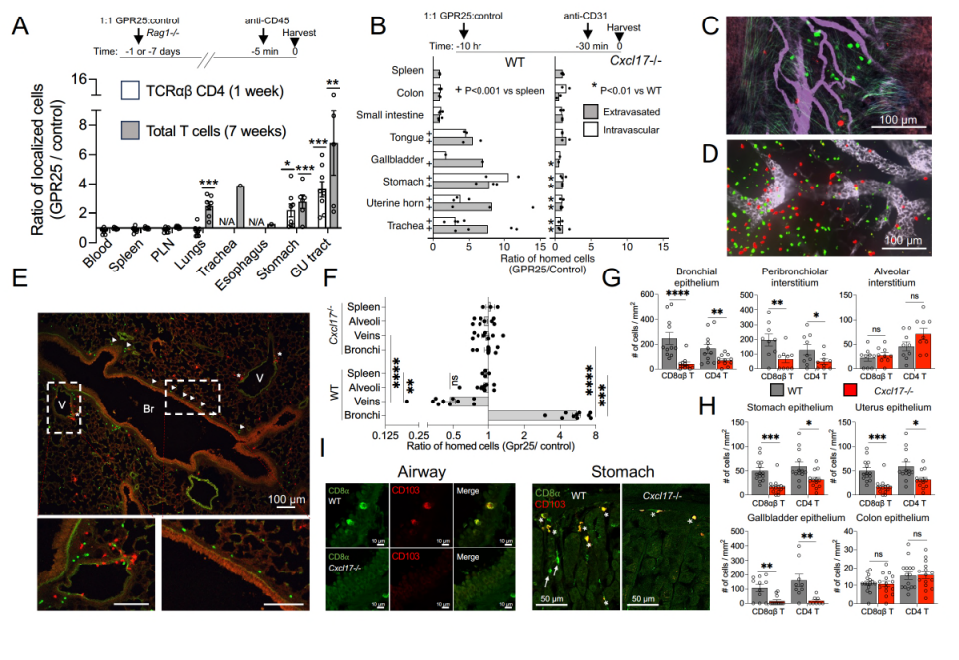
图6. 体内实验验证GPR25-CXCL17轴介导的淋巴细胞
归巢作用
总体来说,本研究证实了GPR25-CXCL17轴介导的淋巴细胞趋化作用的存在,并揭示了其在调节粘膜免疫和免疫耐受中的重要意义,这一发现为开发新的免疫治疗策略提供了潜在的靶点。例如,通过调节GPR25的表达或CXCL17的活性并与CAR-T等免疫细胞疗法共同联用,可能有助于对包括自身免疫疾病、感染性疾病和肿瘤在内的疾病进行治疗。在未来,可以通过人类样本进一步探索这一轴向作用在不同疾病中的所扮演的角色,并尝试通过对其的干预达到治疗疾病的目的。









