临床应用CAR-T等细胞产品后的不良风险有效控制(下)
03.肿瘤细胞溶解综合征(TLS)
由于肿瘤细胞的大量崩解,释放出其细胞内容物和代谢产物导致电解质紊乱而引起的相关综合征:包括高尿酸血症、高磷酸血症、低钙血症、高钾血症、急性尿酸性肾病甚至死亡[1]。不同于CRS,TLS主要发生在T细胞激活的高峰,延迟于CRS。通常发生于治疗前有较大肿瘤负荷的患者,所以在治疗前,进行肿瘤负荷的预处理是避免发生严重TLS所必不可少的。对于TLS的病人,要密切关注病人的生命体征及出入量,监测病人的肝肾功能、电解质,遵医嘱予病人大量水化、碱化、利尿等的治疗。如低钙血症主要表现为抽搐、手足麻木等,发生抽搐时,应立即给予平卧位,头偏向一侧,保持呼吸道通畅,遵医嘱给予葡萄糖酸钙缓慢滴注;高钾血症主要表现为全身无力、心律不齐等[2],指导病人限制高钾饮食,减少食用钾含量高的水果,遵医嘱给予葡萄糖酸钙、胰岛素等药物治疗[3];对于严重的病人,应尽早进行透析治疗;正确维护透析导管保持管路的通畅性。如图1所示,根据中国研究型医院学会生物治疗学专委会提出的“CAR-T细胞治疗NHL毒副作用临床管理专家共识”,给出了较为详细的诊断、预防和治疗方法的建议[1]。
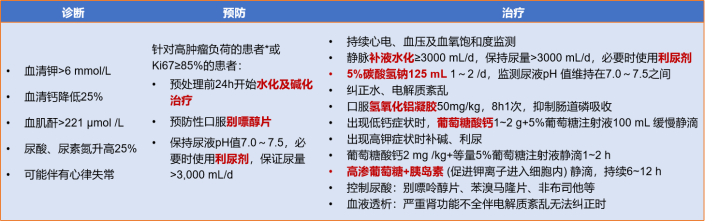
图1:肿瘤细胞溶解综合征(TLS)的预防和治疗
04.巨噬细胞活化综合征(MAS)/噬血细胞淋巴组织细胞增多症(HLH)
HLH/MAS是以巨噬细胞、淋巴细胞过度激活,促炎因子产生,淋巴组织细胞浸润,免疫介导多器官衰竭为特征的严重免疫功能失调综合征,其临床特征和实验室检查与CRS相似,包括高热,多器官功能衰竭,血清铁蛋白、乳酸脱氢酶、可溶性CD25、细胞因子(如IFN-γ和IL-6)水平升高,纤维蛋白原水平下降。所以,HLH/MAS、CRS 可能都属于类似的系统性高炎症反应,这使CRS背景下HLH/MAS的诊断难度增加。
IFN-γ可以促进巨噬细胞分泌促炎因子,产生多量的超氧阴离子和氧自由基,增强其杀伤活性,促炎因子是宿主防御的重要组成部分,但过度激活,大量细胞因子可能对宿主产生损伤,在这一点上与CRS有一定的相似性。由此可以看出MAS的发生和CRS的发生存在相似的病理生理基础,因此MAS容易被忽略。治疗上应选择IL-6受体拮抗剂、糖皮质激素、对症治疗,如果症状48小时内未缓解则使用依托泊苷,出现HLH相关神经系统毒性时可考虑鞘内注射阿糖胞苷和(或)氢化泼尼松[4]。
05.外周血细胞减少
CAR-T细胞输注后,部分患者可出现严重的血小板、中性粒细胞减少,在输注后1个月都没有恢复,可能与骨髓造血功能的破坏/抑制有关。Fried等[5]研究发现,延长的血细胞减少更常见于发生高级别CRS(NCI2017标准)的患者,基质细胞衍生因子-1(SDF-1)水平的紊乱可能是中性粒细胞减少症的原因,且可能与B细胞恢复竞争造血因子SDF-1有关。Nahas等[6]研究发现,淋巴清除化疗时血小板<75000/μL和CAR-T 细胞输注后第0天或第1天发生高级别CRS是持续血细胞减少的独立预测因子。
造血恢复延迟期也是CAR-T治疗后感染最常发生的时期,CRS的严重程度是唯一与感染相关的独立危险因素,因此,控制CRS至关重要,但托珠单抗的使用会使中性粒细胞减少加重,增加感染风险,所以可以在清除淋巴细胞阶段就预防性使用抗生素,减少致命感染的发生。该类患者可使用生长因子支持和输血来治疗中性粒细胞减少症、贫血和血小板减少症,长期4级中性粒细胞减少症患者应考虑使用抗菌药物预防细菌/真菌感染。如图2所示,根据中国研究型医院学会生物治疗学专委会提出的“CAR-T细胞治疗NHL毒副作用临床管理专家共识”[1],为保证治疗的顺利进行,降低骨髓抑制期感染及相关并发症,处理措施建议如下。
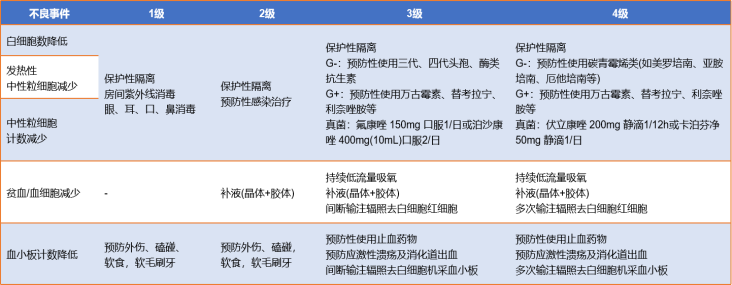
图2:血细胞减少的分级和处理
06.B细胞再生障碍/低丙种球蛋白血症
B细胞再生障碍/低丙种球蛋白血症是CAR-T细胞治疗后的特征性不良反应之一,几乎所有接受CAR-T细胞治疗患者均会呈现不同程度的B细胞再生障碍,以及由此导致的体液免疫功能不全相关的感染风险[1]。临床表现为B细胞绝对值<61细胞/µL;lgG≤400mg/dL。
抗CD19 CAR-T细胞治疗后,尤其是 CAR-T 细胞在体内存在超过3个月的患者可能会发生B细胞耗竭和低免疫球蛋白血症等非肿瘤靶点的不良反应,75%有持续应答的患者在24个月内出现B细胞恢复,部分患者可在第9个月时出现B细胞恢复。为及时诊断发现细胞再生障碍,需要在CAR-T细胞治疗后应监测免疫球蛋白水平,针对高危人群 (lgG≤4g/L、严重感染、持续感染或反复感染者),注意定期监测血清lgG、lgM、lgA及外周血中CD19+或CD20+B细胞数量等。
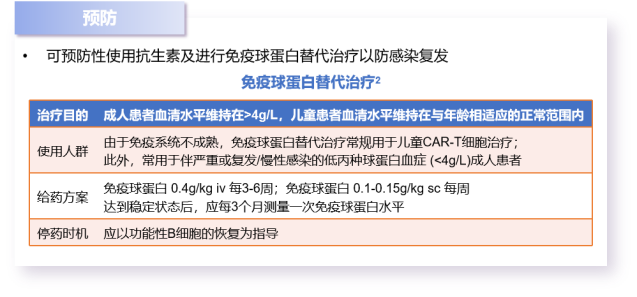
图3:细胞再生障碍的预防和治疗
07.机会性感染
机会性感染风险因素包括既往ASCT/allo-HCT、桥接治疗和类固醇/托珠单抗用于CRS/ICANS治疗。大多数早期感染 (前30天)为细菌或呼吸道病毒感染,侵袭性真菌感染罕见;30天后以病毒感染为主。CAR-T细胞治疗后G-CSF早期应用的负面影响尚未得到明确的证实;近期一份在CAR-T细胞输注后第5天开始G-CSF治疗的报告显示,CRS或ICANS发生率未增加,表明早期应用可能是安全的且可能缩短中性粒细胞减少的持续时间;需要进一步数据以支持该观察结果,在出现发热性中性粒细胞减少的患者中,强烈建议广谱抗生素经验性治疗[1]。

图4:机会性感染的应对策略
08.脱靶效应
理想的靶抗原是仅存在于肿瘤细胞(即肿瘤特异性抗原TSA),为肿瘤细胞恶性克隆提供重要生存信号。不幸的是大部分CAR-T细胞靶标与正常组织具有共同的抗原,即肿瘤相关性抗原TAA,其在正常组织和细胞表面也有不同程度表达。CAR-T细胞在杀伤肿瘤细胞的同时,对表达TAA的正常组织和细胞进行攻击,从而引起一系列的全身反应是所谓的“脱靶现象(ontarget/off-tumor recognition)”不良反应。这种不良反应可以从轻微的单系别缺乏如B细胞再生障碍性贫血到严重的不良反应死亡,这种不良反应在很多器官中是可以预测的,如胃肠道、血液系统、呼吸系统。
目前已知的TSA较少,少数CAR-T试验针对前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)和表皮生长因子受体Ⅲ(epidermal growth-factor receptor variant Ⅲ,EGFRvⅢ)等TSA。探究避免脱靶效应的方法成为许多机构的研究方向。目前研究较多的几个解决脱靶的方向是:(1)双靶点以及多靶点抗原的开发。即在设计中使用2个不同的靶点作为CAR的刺激信号,只有2个信号共同激活时,才可以发挥作用,作用单个信号时不能激活T细胞,从而减弱对正常细胞的损伤作用;(2)运用转基因技术在CAR-T细胞中导入自杀基因或抑制基因,构建抑制性CAR[7],在发生不良反应时,及时进行药物或其他方式诱导,使体内CAR-T细胞凋亡[8]。对于脱靶效应带来的损伤,对症处理即可,如在出现低免疫球蛋白血症时输注免疫球蛋白等。但脱靶效应的产生在一定程度上可以反映体内CAR-T细胞的活性,评估输注细胞在体内的工作情况。
09.其他
过敏反应:目前临床试验应用的转基因T细胞含有抗原识别区域,大部分取自小鼠单克隆抗体。因此,CAR-T细胞输注后因为外来蛋白的免疫原性会引起细胞和体液免疫反应。目前正在努力使表达蛋白人源化,以产生持久和强有力的临床抗肿瘤效果。更急性的不良反应是宿主识别输入的外来成分导致急性过敏反应。
插入突变:美国食品药品监督管理局(FDA)要求已上市的CAR-T疗法添加T细胞癌症风险的黑框警告,但CAR-T治疗目前治疗仍是收益大于其风险。CAR-T先驱、美国宾夕法尼亚大学佩雷尔曼医学院细胞免疫治疗中心和病理学与检验医学系布鲁斯·莱文(Bruce L. Levine)和卡尔·朱尔(Carl H. June)等十多位专家在《自然-医学》就发表了题为《CAR-T 细胞治疗后继发性恶性肿瘤报告后的未解答问题》的文章,指出到目前为止,估计有34400名患者接受了CAR-T疗法,观察到的T细胞肿瘤的发生率远低于其他一些疗法[9]。事实上,任何化疗放疗靶向免疫手段,都有可能导致发生二次癌症(二次癌),但这一概率非常低,约在0.1%-1%之间。无论对于临床医生还是生死濒临一线的终末期患者而言,这一风险都处于可接受范围。
病毒再激活:直接针对B细胞的药物可导致乙肝病毒(HBV)再激活,可导致爆发性肝炎、肝衰竭、死亡等严重后果。DLBCL中HBV感染(HBsAg阳性)约占25%~61%,对于HBV感染患者后续使用CAR-T细胞治疗,是否会引起HBV 再激活。Yang等[10]人的研究发现,20%(3/15)慢性HBV感染患者在CAR-T细胞治疗后HBV病毒被激活,但不影响CAR-T细胞治疗的疗效。未避免病毒再次被激活,需要注意在单个核细胞采集前按照临床常规进行HBV、HCV和HIV筛查,遵医嘱定期复查,根据结果有必要进行抗病毒治疗。
参考文献
[1] 中国研究型医院学会生物治疗学专委会. CAR-T细胞治疗NHL毒副作用临床管理专家共识. 转化医学杂志 2021; 10(1):1-11.
[2] 丁亚光,赵文,吴心怡,等.神经母细胞瘤患儿接受嵌合抗原受体修饰T细胞回输后不良反应的护理[J].中华护理杂志,2017,52(3):307-310.
[3] 阳聪聪,钟竹青,罗优梅,等.难治型多发性骨髓瘤患者2次CAR-T细胞治疗的护理[J].护理学杂志,2019,34(4):34-36.
[4] Schram AM,Nancy B. How I treat hemophagocytic lymphohistiocytosis in the adult patient[J]. Blood,2015,125 (19 ):2908 -2914.
[5] Fried S, Avigdor A, Bielorai B, et al. Early and late hematologic toxicity following CD19 CAR-T cells[J]. Bone Marrow Transplant, 2019, 54(10):1643-1650.
[6] Nahas GR, Komanduri KV, Pereira D, et al. Incidence and risk factors associated with a syndrome of persistent cytopenias after CAR- T
[7] RUSSO V,BONDANZA A,CICERI F,et al . A dual role for genetically modified lymphocytes in cancer immunotherapy[J].Trends Mol Med,2012,18( 4) : 193-200
[8] STRAATHOF K C,PULE M A,YOTNDA P,et al . An inducible caspase 9 safety switch for T-cell therapy[J]. Blood,2005,105( 11) : 4247-4254.
[9] Levine BL, Pasquini MC, Connolly JE, et al. Unanswered questions following reports of secondary malignancies after CAR-T cell therapy. Nat Med. 2024 Feb;30(2):338-341. doi: 10.1038/s41591-023-02767-w. PMID: 38195751.
[10] Yang C, Xie M, Zhang K, et al. Risk of HBV reactivation post CD19-CAR- T cell therapy in DLBCL patients with concomitant chronic HBV infection[J]. Leukemia, 2020. Doi: 10.1038/s41375-020-0913-y
免责声明:深圳细胞谷致力于研究细胞与基因疗法,为推动新兴技术,让更多人了解生物医药新发展。本文内容仅作信息交流使用,本平台对文中内容、陈述、观点判断保持中立,不代表深圳细胞谷立场和观点。本文相关信息不得用作诊断或治疗,不能代替专业医学意见,本公众平台将不承担任何责任。以上声明内容的最终解释权归本公众平台所有,本声明将适用本平台所有时间分享的文章,谢谢合作!
版权说明:文章版权归深圳细胞谷所有,欢迎个人转发至朋友圈,媒体或机构在未经授权下,以任何形式转载到其他平台,将视为侵权。转载授权请在「深圳细胞谷」微信公众号回复“转载”,获取转载须知。









