靶向BCMA的CAR-T研究进展
一、BCMA简介
BCMA又称CD269、TNFRSF13C,是一种Ⅲ型跨膜蛋白,属于肿瘤坏死因子(TNF) 受体 (TNFR) 家族[2]。BCMA 与其他两个功能相关的 TNFR 超家族成员 B 细胞活化因子受体 (BAFF-R) 跨膜激活剂、钙调节剂和亲环素配体相互作用因子(TACI)共同调节B细胞的增殖、成熟和存活,以及向浆细胞的分化[3]。
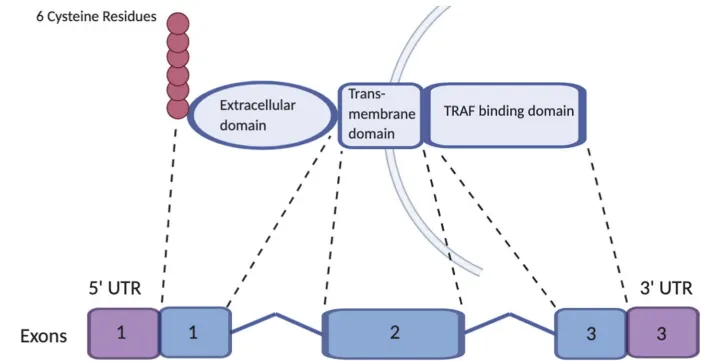
图1:BCMA的分子结构
BCMA在恶性浆细胞中高表达,在正常组织细胞(除浆细胞和部分成熟B细胞)和 CD34+干/祖细胞上不表达,这使得其成为 MM 的靶向位点[1]。如图2所示,BCMA在幼稚B细胞、造血干细胞中检测不到,在大多数正常非血液组织中也检测不到,除了睾丸、气管和一部分胃肠道等,这些器官由于含有PCs而可以检测到。
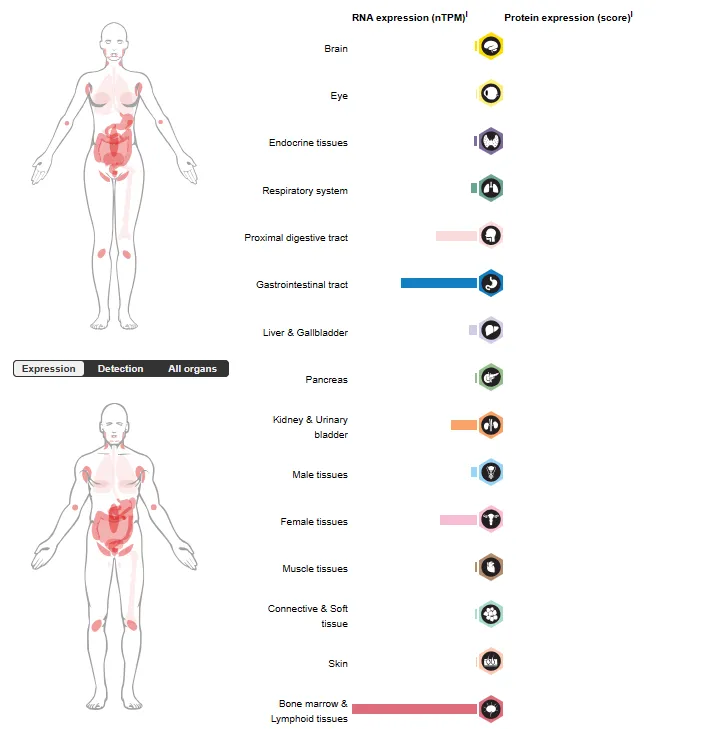
图2:BCMA在人体各组织器官中的分布
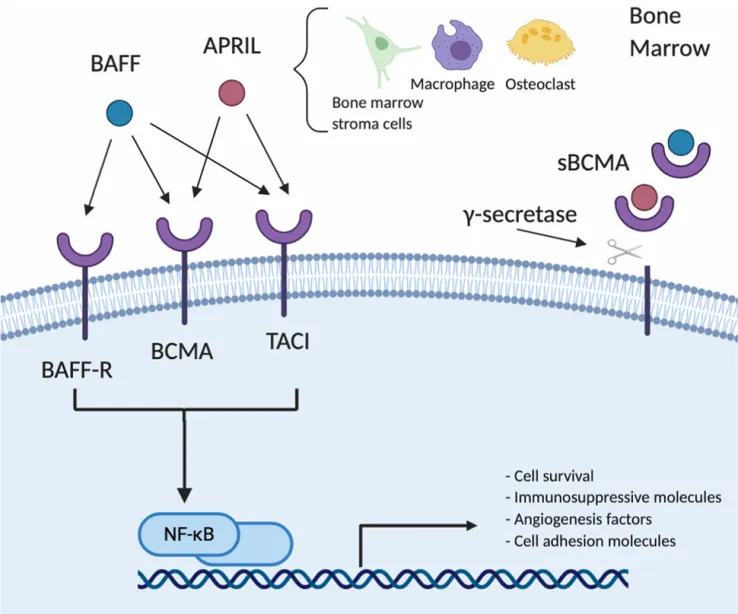
BCMA的主要配体是:B细胞活化因子(BAFF)和增殖诱导配体(APRIL),它们主要由骨髓基质细胞、破骨细胞和巨噬细胞以旁分泌的方式分泌。配体与BCMA结合后,MM细胞中多个生长和存活信号级联被激活,最常见的是活化B细胞的核因子κ-轻链增强子(NF-κβ),这些途径通过调节细胞周期检查点导致MM细胞存活率增加[4]。
二、BCMA CAR-T的临床试验与上市产品
对BCMA靶向药物的具体靶点进行统计,在165款管线药物中,其中以CAR-T为主,共有91个,占总管线药物的55%,BCMA双靶联合的其他靶点主要有CD3,CD19和CD38等。
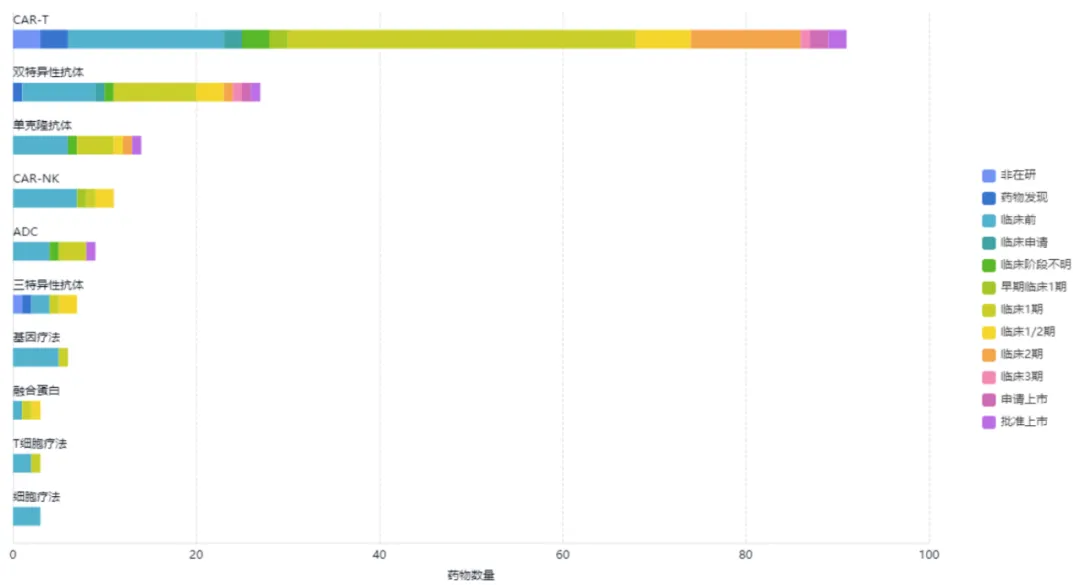
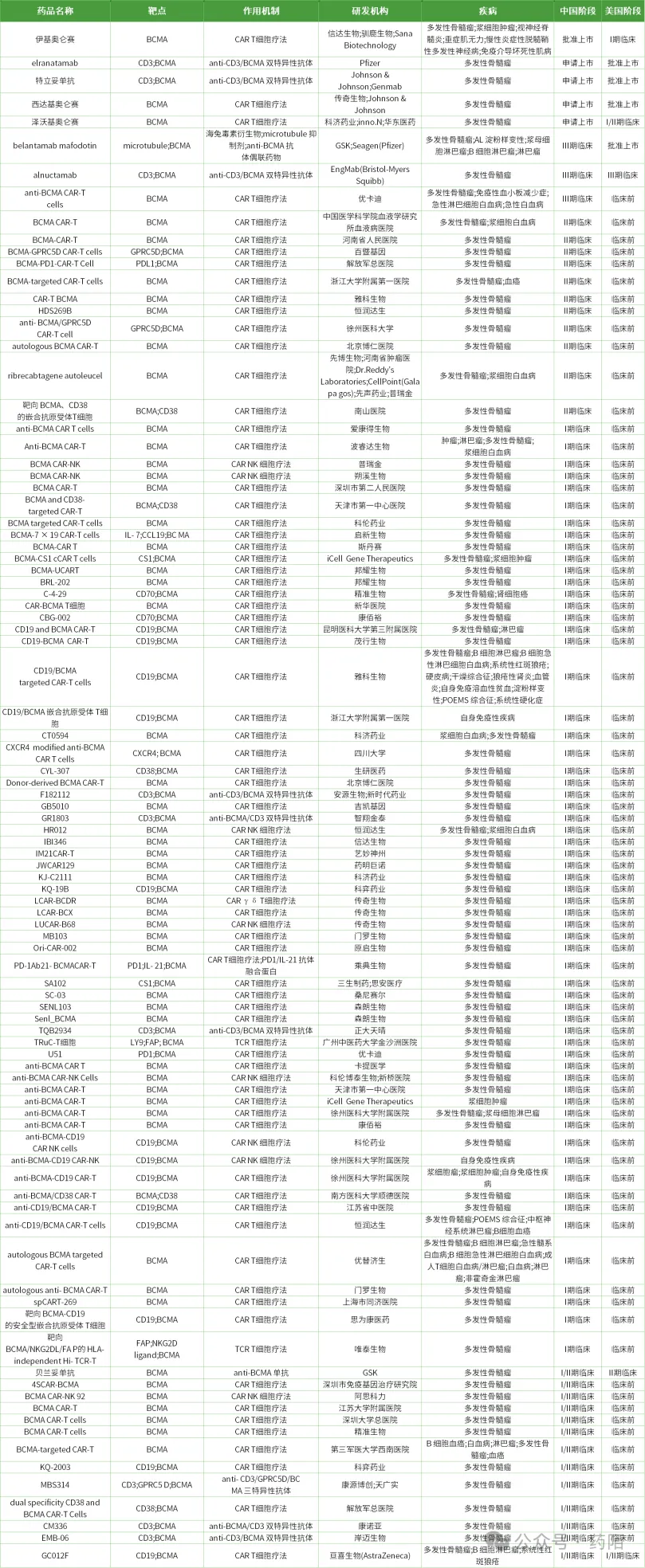
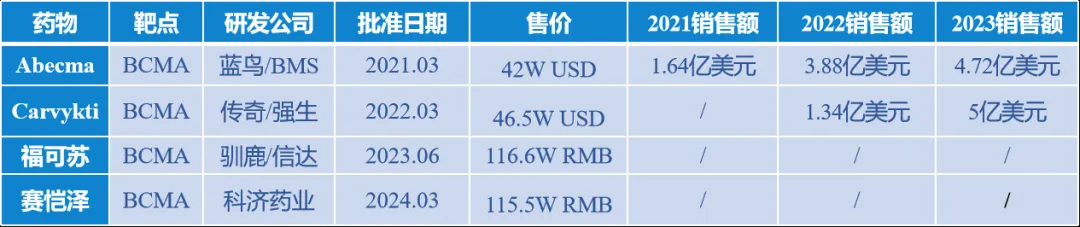
图5:靶向BCMA的产品进展汇总(来源:药陌)
美国FDA对Abecma的批准是基于来自关键性2期临床试验KarMMa的数据可评估疗效的人群由100例接受Abecma治疗的患者组成。在这项研究中,总缓解率(ORR)为72%,其中28%的患者达到了严格的完全缓解(CR)。患者产生应答所需的中位时间为30天,中位缓解持续时间为11个月。
2024年6月3号,传奇生物在2024年美国临床肿瘤学会(ASCO)年会上公布了西达基奥仑赛(CARVYKTI)针对多发性骨髓瘤患者的2期研究CARTITUDE-2队列D的结果。在22个月的中位随访中,单次输注西达基奥仑赛联合或不联合来那度胺维持治疗后的患者(n=17)总缓解率(ORR)达94%(n=16/17),16例患者均达到CR或更好,在15例微小残留病(MRD)可评估的患者中,80%的患者达到10-5MRD阴性。[6]
2023年6月30日驯鹿生物与信达生物联合开发的BCMA全人源靶向CAR-T产品伊基奥仑赛注射液(福可苏)获批上市,用于治疗RRMM成人患者,既往经过至少3线治疗后进展。2024年1月25日,伊基奥仑赛注射液新适应症获批IND,拟用于治疗难治性全身型重症肌无力。2024年3月28日IND拟扩大适应症用于治疗既往经过1-2线治疗且来那度胺耐药的RRMM患者。2023年ASCO年会上更新的伊基奥仑赛注射液治疗RRMM的1/2期注册临床研究(FUMANBA-1) 结果显示,回输剂量为1.0×106 CAR-T/kg,中位随访时间为13.8(0.4, 27.2)个月,在疗效可评估的101例受试者中,总体缓解率为96.0%(97/101),其中91.1%(92/101)受试者达到非常好的部分缓解及以上(≥VGPR),严格意义的完全缓解/完全缓解率为74.3%(75/101)。
科济药业的赛恺泽上市申请是基于在中国进行的一项开放、单臂1/2期临床试验LUMMICAR STUDY 1的数据在2023年12月举行的ASH年会上,研究结果显示,截至2022年8月16日,102例患者的中位随访时间为9个月,客观缓解率为92.2%,非常好的部分缓解及以上缓解的比率为85.3%,完全缓解比率为45.1%。
深圳细胞谷运用自主生产的工业级逆病毒载体制备靶向CD19、CD38、BCMA-CD38双靶点等多款CAR-T细胞,转导效率可达到50%以上,可完成从T淋巴细胞的采集、肿瘤靶点病毒载体的转导、CAR-T细胞扩增、安全性检测到放行的全流程服务。深圳细胞谷已经和华中科技大学深圳协和医院,广州妇女儿童医院等多家医院合作开展CAR-T临床研究,能够提供高标准的CAR-T细胞产品,已经用于三十余例临床患者,治疗效果显著。从拿到临床提供的病人血样当天计算,约12天就能完成细胞制备,省内可采取新鲜制剂形式运输,2-8℃运输,50ml/回输袋;省外可冻存制剂运输。
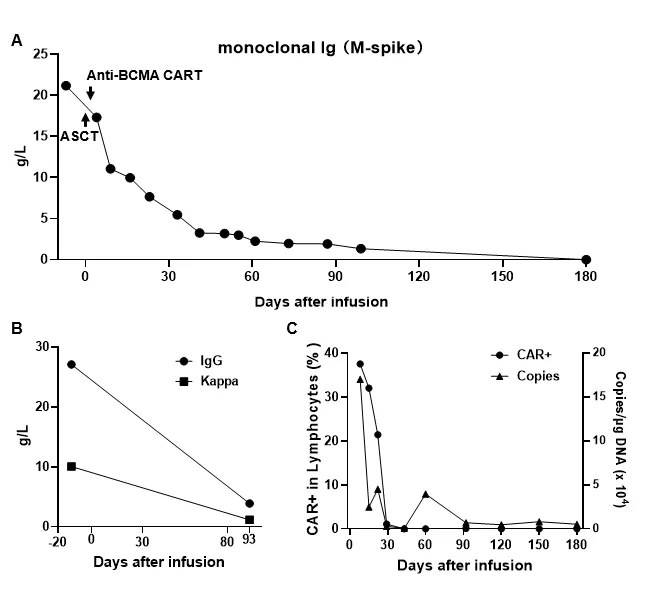
目前Anti-BCMA CAR-T临床研究已入组3名多发性骨髓瘤患者,一名BCMA CAR-T细胞治疗耐药难治性多发性骨髓瘤患者已出院数月达到完全缓解,M蛋白已下降至0g/L!
患者1,男,41岁,初期检测血清M蛋白含量70.28g/L,经过VCD、VRD、DKd、DKRd±苯达莫司汀等治疗PR后疾病进展,病情控制不佳,经过多重化疗后血清M蛋白含量降至20.23 g/L并产生骨髓抑制,经过专家评估后,2023-8-26采用ASCT和靶向BCMA的CAR-T细胞联合治疗。ASCT和靶向BCMA CAR-T输注33天后,血清M蛋白降至5.46 g/L,显著降低90%以上,达到VGPR,第三个月血清M蛋白降至1.35 g/L,第6个月已经检测不到;IgG和血清Kappa含量也持续降低,第6个月IgG转阴,评判CR,现已治疗9个多月未见患者复发。
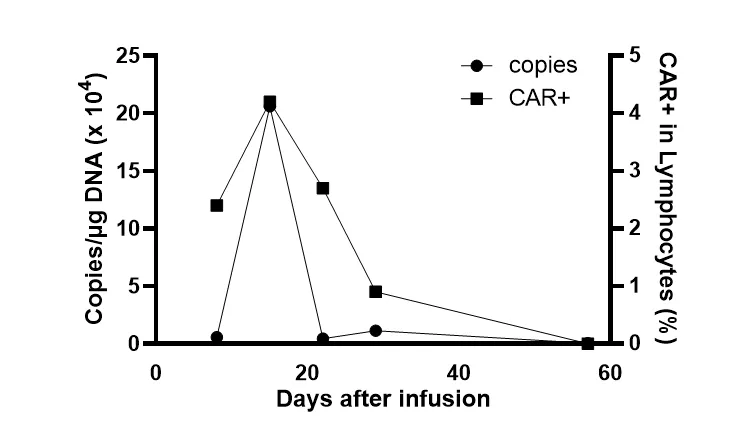
图8:病例2输注后第15天CAR 拷贝数增至206163 copies/ug
参考资料
[1] 刘佳慧,邱录贵,安刚.靶向B细胞成熟抗原在多发性骨髓瘤中的治疗进展[J].中国肿瘤临床,2022,49(20):1039-1046.
[2] 杜文,王晓青,成娟,等.靶向BCMA CAR-T细胞在复发难治性多发性骨髓瘤中的治疗进展[J].中国肿瘤临床,2021,48(16):858-862.
[3] Coquery CM, Erickson LD. Regulatory roles of the tumor necrosis factor receptor BCMA. Crit Rev Immunol. 2012;32(4):287–305.
[4] Carpenter RO, Evbuomwan MO, Pittaluga S, et al. B-cell maturation antigen is a promising target for adoptive T-cell therapy ofmultiple myeloma[J]. Clin Cancer Res, 2013, 19(8):2048-2060.
[5] Yu B, Jiang T, Liu D. BCMA-targeted immunotherapy for multiple myeloma. J Hematol Oncol. 2020;13(1):125. Published 2020 Sep 17. doi:10.1186/s13045-020-00962-7
[6] 传奇生物在ASCO和EHA公布CARVYKTI®用于治疗多发性骨髓瘤迄今最早的数据及重要的亚组分析. Retrieved June 04, 2024, from http:/mp.weixin.qq.com/s/EIVqa50eOpZCDAdVDD14Rg