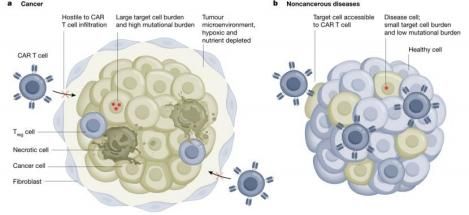
免疫细胞治疗在非肿瘤领域开拓
SLE(系统性红斑狼疮)是一种可能危及自身生命的免疫性疾病,2021年到2022年,有研究团队先后注入anti-CD19(B 细胞的特异性抗原)的 CAR-T 进入到 6 名患者体内,所有患者体内CAR-T 细胞均出现扩增,B细胞快速被消 灭,SLE症状得到缓解,终末器官损伤标志物明显下降。所有患者均停止了免疫抑制药物治疗,处于无药物缓解状态。短期随访显示,在 CAR-T 细胞输注几个月后,幼稚 B 细胞重新出现,并且没有出现疾病复发的征兆。CAR-T 细胞的给药耐受性良好,仅出现轻度 CRS 病例,这与较低的靶细胞负荷可能减轻 CRS 严重程度的观点一致。[2]
Anti-CD19 CAR-T 细胞同样被用于抗合成酶综合征导致的炎症性肌病患者。为病人进行 CAR-T 细胞输注后,患者肌痛加剧,血清肌酐激酶升高,输注180天后,其身体机能显著改善,股四头肌和腿筋肌炎逐渐消退,肌酸酐激酶以及其他临床指标也逐渐正常。[3]
其实,只要是由于 B 细胞或者浆细胞的自身免疫与炎症疾病都可能是CAR-T治疗的潜在适应症,包括中性粒细胞胞浆抗体相关性血管炎、类风湿性关节炎、肌炎、多发性硬化症、寻常型天疱疮、免疫性血小板减少症、重症肌无力和视神 经脊髓炎等等。并且,只要是针对 B 细胞或者浆细胞杀伤的靶点(BCMA,GPRC5D, CD20 and CD22)都有可能成为潜在的 CAR-T 治疗靶点。[3-4]
消除炎症细胞的另一种方法是将调节性T (Treg) 细胞重定向到靶组织。这 些细胞没有细胞毒性,但提供旁分泌信号来抑制炎症和自身免疫反应。将 CAR 转染到 Treg 细胞中可以提高特异性并降低全系统免疫抑制的风险。
目前,各种自身免疫疾病的 CAR-T 临床试验及临床前研究都证明该类疾病 可能是 CAR-T 疗法最有前景的领域之一。
二、脏器纤维化
心脏纤维化是急性损伤、慢性疾病或衰老导致的,它会导致近期的发病率和长期的死亡率增加。目前,针对心脏纤维化的治疗方法有限。最近的临床前研究表明, CAR-T 细胞可以针对纤维化并在高血压损伤后恢复心脏功能。研究人员 在心肌病患者的心脏中鉴定了纤维母细胞特异性抗原,发现纤维母细胞活化蛋白(FAP)是表达最高的靶点。注入 anti-FAP CAR-T 细胞可以在心脏损伤后解决纤维化问题,并改善心脏功能。使用 CAR-T 细胞靶向病理性纤维化的意义不仅仅限于心脏病。细胞外基质的沉积和纤维化在多种疾病中都是病理性的。肝脏疾病、慢性肾脏疾病、肺部疾病、骨骼肌疾病等许多其他情况都可以尝试使用抗纤维化 CAR-T 细胞进行治疗。
三、衰老
多种应激源可导致细胞经历不可逆的增殖停滞,称为细胞衰老。研究表明,去除这些细胞对各种慢性疾病模型有益。靶向衰老细胞的细胞内通路的小分子药物似乎很有前途,但其药效、特异性和副作用限制了它的发展。CAR-T因其固有的特异性和效力被研究者认为是极具竞争力的新型疗法。衰老细胞在生命早期 就被免疫系统生理清除,利用 CAR 增强免疫细胞并延长这一过程可能使机体获得更大收益。
最新研究表明,CAR-T 细胞可以清除癌症和肝病小鼠的衰老细胞。PLAUR 编码尿激酶型纤溶酶原激活剂受体 (uPAR),被认为是一种潜在的血清抗原,并且在重要组织中表达水平相对较低。Anti-uPAR CAR-T 能成功消除癌基因诱导 的肝脏衰老细胞、肿瘤治疗诱导的肺部衰老细胞、药物诱导的肝纤维化和饮食诱 导的非酒精性脂肪性肝炎衰老细胞。由于衰老细胞具有异质性,因此鉴定衰老抗 原既困难又重要。其他可用于生成衰老 CAR-T 细胞的靶标包括 NKG2D 配体、 MICA、MICB 和 ULBP1-5,它们在多种衰老细胞中表达,另一个潜在靶点是糖蛋白非转移性黑色素瘤蛋白 B (GPNMB),针对这一靶点的免疫治疗可以清除衰老细胞,改善代谢参数,减少动脉粥样硬化斑块并延长雄性早衰小鼠的寿命。因此,GPNMB 可能是 CAR-T 疗法的合适衰老靶点。[5]
四、感染
靶向非机体的抗原将大大降低 offtumor 的毒性风险。正如前所述,CAR-T 的初衷是为了治疗 HIV 感染病人。病毒感染宿主细胞后,将在细胞表面显示特异性的抗原,针对这些抗原设计的 CAR-T 将具有清除感染的潜力。随着 CAR-T 结构的优化,基于二代结构的 CAR-T 也被应用于 HIV 的治疗,相关的临床实验正在积极的开展。还有利用真菌模式识别受体开发的 CAR-T,可以识别真菌细胞壁中的碳水化合物抗原。这种方法在体外和小鼠模型中具有显著的抗真菌特性。同样,近期研究测试了 CAR-T 细胞对抗侵袭性肺曲霉病的功效,表明该 CAR-T 细胞在体外和侵袭性肺曲霉病小鼠模型中均显示出抗真菌特性。
虽然 CAR-T 在慢性感染方面有着广阔的发展空间,但是对于急性感染,需要紧急反应,当前 CAR-T 离体生产过程还需进一步优化。
五、移植物抗宿主病(GvHD)
CAR-T细胞疗法可以通过识别和消灭引发 GvHD 的免疫细胞来减轻炎症反应。有研究尝试设计anti-OX40 CAR-T(OX40,急性 GvHD 中致病性 T 细胞中上调的一种蛋白质),以针对 GvHD 相关的免疫细胞进行清除。
以上总结了 CAR-T 在非癌症疾病领域的临床与临床前研究,结果表明免疫细胞治疗方式确实能够通过清除特定的病变细胞,减轻甚至治愈多种疾病。并且相较于小分子药物与单克隆抗体有更彻底、更持久的治疗效果。累累硕果让更多的研究者相信 CAR-T 细胞疗法将会开拓出超越肿瘤治疗的全新战场。
参考文献
[1] Baker DJ, Arany Z, Baur JA, Epstein JA, June CH. CAR T therapy beyond cancer: the evolution
of a living drug. Nature. Jul 2023;619(7971):707 -715. doi:10.1038/s41586-023-06243-w
[2] Mougiakakos D, KrönkeG, Völkl S, et al. CD19-Targeted CAR T Cells in Refractory Systemic Lupus Erythematosus. NEnglJ Med. 2021;385(6):567-569. doi:10.1056/NEJMc2107725
[3] Müller F, Boeltz S, KnitzaJ, et al. CD19-targeted CAR T cells in refractory antisynthetase syndrome. Lancet. 2023;401(10379):815-818. doi:10.1016/S0140-6736(23)00023-5
[4] Granit V, Benatar M, Kurtoglu M, et al. Safety and clinical activity of autologous RNA chimeric antigen receptor T-cell therapy in myasthenia gravis (MG-001): a prospective, multicentre, open-label, non-randomised phase 1b/2a study [published correction appears in Lancet Neurol. 2023 Sep;22(9):e10] [published correction appears in Lancet Neurol. 2023 Sep;22(9):e10]. Lancet Neurol. 2023;22(7):578-590. doi:10.1016/S1474-4422(23)00194- 1
[5] Suda, M., Shimizu, I., Katsuumi, G. et al. Senolytic vaccination improves normal and pathological age-related phenotypes and increases lifespan in progeroid mice. Nat Aging 1, 1117– 1126 (2021).
https://doi.org/10.1038/s43587-021-00151-2
免责声明:深圳细胞谷致力于研究细胞与基因疗法,为推动新兴技术,让更多人了解生物医药新发展。本文内容仅作信息交流使用,本平台对文中内容、陈述、观点判断保持中立,不代表深圳细胞谷立场和观点。本文相关信息不得用作诊断或治疗,不能代替专业医学意见,本公司网站将不承担任何责任。以上声明内容的最终解释权归本公司网站所有,本声明将适用本公司网站所有时间分享的文章,谢谢合作! 版权说明:文章版权归深圳细胞谷所有,欢迎个人转发发至朋友圈,媒体或机构在未经授权下,以任何形式转载载到其他平台,将视为侵权。如需转载,请联系邮箱:contact@sz-cell.com